题目内容
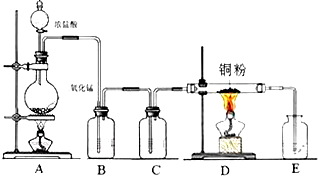
实验室里用图所示装置制取纯净的无水CuCl2.试回答下列问题:已知烧瓶内发生的是制取氯气的反应:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O
(1)用双线桥法标出烧瓶内发生反应的电子转移方向和数目MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O.
(2)B处盛有饱和食盐水,其作用是
(3)C处盛放的是下列试剂中的
a、水 b、氢氧化钠溶液 c、浓硫酸 d、饱和食盐水
(4)有同学认为该装置存在缺陷,改进的方法是
| ||

(1)用双线桥法标出烧瓶内发生反应的电子转移方向和数目MnO2+4HCl(浓)
| ||
(2)B处盛有饱和食盐水,其作用是
除去Cl2中的HCl
除去Cl2中的HCl
.(3)C处盛放的是下列试剂中的
c
c
(填序号);E处盛放的是下列试剂中的b
b
(填序号),发生反应的离子方程式为Cl2+2OH-═Cl-+ClO-+H2O
Cl2+2OH-═Cl-+ClO-+H2O
.a、水 b、氢氧化钠溶液 c、浓硫酸 d、饱和食盐水
(4)有同学认为该装置存在缺陷,改进的方法是
在DE之间加盛有碱石灰的干燥管
在DE之间加盛有碱石灰的干燥管
.分析:(1)A为制备氯气装置,装置A中反应为二氧化锰与盐酸反应生成氯化锰、氯气、水.根据化合价变化标出电子转移的方向和数目;
(2)制纯净干燥的氯气,要除去混在氯气中的氯化氢和水蒸气.除去氯化氢气体用饱和食盐水;
(3)制纯净干燥的氯气,要除去混在氯气中的氯化氢和水蒸气.除去氯化氢气体用饱和食盐水,除去水蒸气用浓硫酸.应先除氯化氢,后干燥,尾气中含有氯气,污染环境,用氢氧化钠溶液吸收,氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水;
(4)根据实验目的是制备无水氯化铜分析判断;
(2)制纯净干燥的氯气,要除去混在氯气中的氯化氢和水蒸气.除去氯化氢气体用饱和食盐水;
(3)制纯净干燥的氯气,要除去混在氯气中的氯化氢和水蒸气.除去氯化氢气体用饱和食盐水,除去水蒸气用浓硫酸.应先除氯化氢,后干燥,尾气中含有氯气,污染环境,用氢氧化钠溶液吸收,氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水;
(4)根据实验目的是制备无水氯化铜分析判断;
解答:解:(1)A为制备氯气装置,装置A中反应为二氧化锰与盐酸反应生成氯化锰、氯气、水,反应方程式为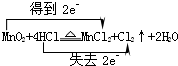 ,
,
故答案为: ;
;
(2)浓盐酸具有挥发性,所以制备的氯气中含有氯化氢,氯化氢极易溶于水,氯气的溶解度较小,所以可用饱和食盐水(或水)除去氯气气体中的氯化氢,
故答案为:除去Cl2中的HCl;
(3)因为题中要求制取纯净的无水CuCl2,所以要除去氯气中混有的水蒸气,且不引进新的杂质,氯气也和该物质不反应,所以选择浓硫酸干燥,
尾气中含有氯气,氯气有毒,污染环境,不能直接排放到大气中.常用氢氧化钠溶液吸收,氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,反应离子方程式为
Cl2+2OH-═Cl-+ClO-+H2O;
故答案为:c;b;Cl2+2OH-═Cl-+ClO-+H2O;
(4)装置制取纯净的无水CuCl2,为防止氢氧化钠溶液中的水蒸气进入装置D,可以在DE之间加一个盛碱石灰的干燥管;
故答案为:在DE之间加一个盛碱石灰的干燥管;
 ,
,故答案为:
 ;
;(2)浓盐酸具有挥发性,所以制备的氯气中含有氯化氢,氯化氢极易溶于水,氯气的溶解度较小,所以可用饱和食盐水(或水)除去氯气气体中的氯化氢,
故答案为:除去Cl2中的HCl;
(3)因为题中要求制取纯净的无水CuCl2,所以要除去氯气中混有的水蒸气,且不引进新的杂质,氯气也和该物质不反应,所以选择浓硫酸干燥,
尾气中含有氯气,氯气有毒,污染环境,不能直接排放到大气中.常用氢氧化钠溶液吸收,氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,反应离子方程式为
Cl2+2OH-═Cl-+ClO-+H2O;
故答案为:c;b;Cl2+2OH-═Cl-+ClO-+H2O;
(4)装置制取纯净的无水CuCl2,为防止氢氧化钠溶液中的水蒸气进入装置D,可以在DE之间加一个盛碱石灰的干燥管;
故答案为:在DE之间加一个盛碱石灰的干燥管;
点评:本题有一定的综合性,把氯气的实验室制法和氯气的化学性质结合起来.考查学生对实验原理、实验装置的理解、物质的制备与性质,难度中等,实验室制取氯气的注意事项:1、必须用浓盐酸,稀盐酸不反应.2、为了减少制得的氯气中氯化氢的含量,所以加热温度不宜过高,浓盐酸具有挥发性.3、实验结束后,先使反应停止并排出残留的氯气,再拆卸装置,避免污染空气.4、尾气吸收时,不能用澄清石灰水吸收氯气,因为溶液中含有氢氧化钙的量少,吸收不完全.

练习册系列答案
相关题目
实验室里用下图所示仪器和药品来制取纯净的无水氯化铜。图中A、B、C、D、E、F表示玻璃管接口,接口的弯曲和伸长部分未画出。根据要求填写下列各小题的空白。?
序号 | ① | ② | ③ |
仪器及装置图 |
|
|
|
序号 | ④ | ⑤ | ⑥ |
仪器及装置图 |
|
|
|
(1)如果制取的气体从左向右流时,上述各仪器装置的正确连接顺序是(填各装置的序号):( )接( )接?( )?接( )接( )接( );其中,②与④装置相连时,玻璃管接口应是 接 (用装置中的字母表示)。?
(2)装置②的作用是 ;装置④的作用是 ;装置⑥中发生反应的离子方程式是 。?
(3)实验开始时,应首先检验装置的 ,其方法是 ;实验结束时,应先熄灭 处的酒精灯。?
(4)在装置⑤的烧瓶中,发生反应的化学方程式为 。?
(5)待充分反应后,装置①的玻璃管中剩余物呈 色,冷却后,将制得的产物配成饱和溶液,溶液呈 色。