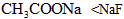题目内容
已知HF比CH3COOH易电离.关于物质的量浓度、体积都相同的NaF溶液和CH3COONa溶液,下列说法正确的是( )
分析:HF比CH3COOH易电离,则酸性HF>CH3COOH,由盐类水解越弱越水解可知,物质的量浓度、体积都相同的NaF溶液和CH3COONa溶液,CH3COONa水解程度大,以此来解答.
解答:解:A.CH3COONa水解程度大,水解生成醋酸分子,则相同条件下,两溶液比较,NaF溶液中的离子总数较多,故A正确;
B.CH3COONa水解程度大,水解显碱性,在相同条件下,两溶液的pH大小为:CH3COONa>NaF,故B错误;
C.由质子守恒可知,NaF溶液中:c(HF)+c(H+)=c(OH-),故C错误;
D.CH3COONa溶液中,水解显碱性,则c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+),故D错误;
故选A.
B.CH3COONa水解程度大,水解显碱性,在相同条件下,两溶液的pH大小为:CH3COONa>NaF,故B错误;
C.由质子守恒可知,NaF溶液中:c(HF)+c(H+)=c(OH-),故C错误;
D.CH3COONa溶液中,水解显碱性,则c(Na+)>c(CH3COO-)>c(OH-)>c(CH3COOH)>c(H+),故D错误;
故选A.
点评:本题考查离子浓度大小的比较,明确信息得到酸性的强弱是解答的关键,注意盐类水解规律及溶液中的守恒式来解答,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目