题目内容
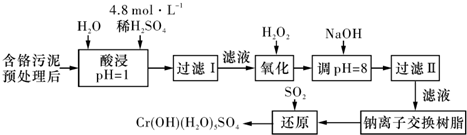
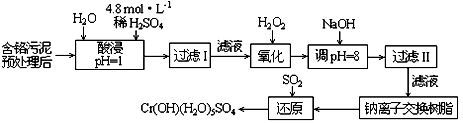
2011年8月12日,《云南信息报》首度披露 了云南曲靖铬污染事件,引起全国广泛关注.工业上将制取重铬酸钾(K2Cr2O7)和铬酸酐(CrO3)的剩余废渣称为铬渣,其成分为:SiO2、Al2O3、MgO、Fe2O3、CrO3、K2Cr2O7等.已知:①重铬酸钾和铬酸酐都易溶于水,这是造成铬污染的主要原因,它们都是强氧化剂,铬酸酐溶于水呈酸性;
②+6价铬易被人体吸收,可致癌:+3价铬不易被人体吸收,毒性小.
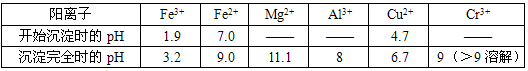
③下表为一些金属氢氧化物沉淀的pH参照数据.
| 物质 | 开始沉淀 | 完全沉淀 |
| Fe(OH)3 | 2.7 | 3.7 |
| Al(OH)3 | 3.7 | 4.7 |
| Cr(OH)3 | 4.7 | a |
| Fe(OH)2 | 7.6 | 9.6 |
| Mg(OH)2 | 9.6 | 11.1 |
(1)将铬渣用稀硫酸浸取、过滤,在浸出液中加入适量的绿矾,加入绿矾的目的是 .
(2)再向浸出液中缓慢加入烧碱,至pH刚好达到4.7,过滤,所得沉淀的化学式是 ;常温下,Cr(OH)3的溶度积Ksp=10-32,要使Cr3+完全沉淀[c(Cr3+)降至10-5mol?L-1视为沉淀完全],溶液的pH应调于a= .
(3)向(2)中得到的滤液中加入硫酸,调节至呈强酸性,所得的溶液是含 溶质的溶液.
【答案】分析:(1)FeSO4?7H2O具有还原性,可与+6价铬发生氧化还原反应生成无毒的+3价铬;
(2)至pH刚好达到4.7,只有Fe(OH)3和Al(OH)3生成,结合溶度积计算;
(3)操作后剩余的金属阳离子为Mg2+和K+,阴离子为SO42-.
解答:解:(1)根据污水中物质的含量可知,加入硫酸后,除SiO2不溶过滤除去外,其他金属离子均生成其简单阳离子,且Cr为+6价,根据题意可知有毒,需要被还原为+3价,
故答案为:将高价有毒的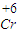 元素含有成无毒的
元素含有成无毒的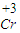 ;
;
(2)结合沉淀的pH,溶液由强酸性到4.7,只有Fe(OH)3和Al(OH)3生成.KspCr(OH)3=c(Cr3+)×c3(OH-),若c(Cr3+)=10-5mol/L时,c(OH-)=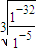 mol/L=10-9mol/L,常温时c(H+)=10-5mol/L,即pH=5时Cr3+沉淀完全,故答案为:Fe(OH)3、Al(OH)3;5;
mol/L=10-9mol/L,常温时c(H+)=10-5mol/L,即pH=5时Cr3+沉淀完全,故答案为:Fe(OH)3、Al(OH)3;5;
(3)根据污水中含有的物质可知,(2)操作后剩余的金属阳离子为Mg2+和K+,硫酸提供阴离子SO42-,故答案为:MgSO4和K2SO4.
点评:本题考查较为综合,侧重于物质的分离、提纯,难溶电解质的相关计算,题目难度中等,明确物质的分离和制备原理为解答该题的关键.
(2)至pH刚好达到4.7,只有Fe(OH)3和Al(OH)3生成,结合溶度积计算;
(3)操作后剩余的金属阳离子为Mg2+和K+,阴离子为SO42-.
解答:解:(1)根据污水中物质的含量可知,加入硫酸后,除SiO2不溶过滤除去外,其他金属离子均生成其简单阳离子,且Cr为+6价,根据题意可知有毒,需要被还原为+3价,
故答案为:将高价有毒的
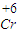 元素含有成无毒的
元素含有成无毒的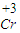 ;
;(2)结合沉淀的pH,溶液由强酸性到4.7,只有Fe(OH)3和Al(OH)3生成.KspCr(OH)3=c(Cr3+)×c3(OH-),若c(Cr3+)=10-5mol/L时,c(OH-)=
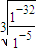 mol/L=10-9mol/L,常温时c(H+)=10-5mol/L,即pH=5时Cr3+沉淀完全,故答案为:Fe(OH)3、Al(OH)3;5;
mol/L=10-9mol/L,常温时c(H+)=10-5mol/L,即pH=5时Cr3+沉淀完全,故答案为:Fe(OH)3、Al(OH)3;5;(3)根据污水中含有的物质可知,(2)操作后剩余的金属阳离子为Mg2+和K+,硫酸提供阴离子SO42-,故答案为:MgSO4和K2SO4.
点评:本题考查较为综合,侧重于物质的分离、提纯,难溶电解质的相关计算,题目难度中等,明确物质的分离和制备原理为解答该题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目