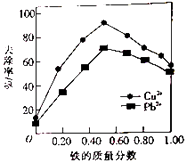
题目内容
【题目】获得“863”计划和中科院“百人计划”支持的环境友好型铝碘电池已研制成功,电解质为AlI3溶液,相关论文发表在J.Am.Chem.Soc.(128,8720~8721,2006)上,已知电池总反应式为2Al+3I2═2AlI3 . 下列说法不正确的是( )
A.该电池负极的电极反应为:Al﹣3e﹣═Al3+
B.该电池可能是一种可充电的二次电池
C.消耗相同质量金属时,用锂作负极产生电子的物质的量比用铝时多
D.电池工作时,溶液中铝离子向正极移动
【答案】B
【解析】解:A.因Al元素的化合价升高,则电池负极的电极反应为Al﹣3e﹣═Al3+ , 故A正确;
B.该电池属于一次电池,不能充电,故B错误;
C.因Al的摩尔质量为27g/mol,由 ![]() ×失去的电子数可知,消耗相同质量金属时,用锂做负极时,产生电子的物质的量比铝多,故C正确;
×失去的电子数可知,消耗相同质量金属时,用锂做负极时,产生电子的物质的量比铝多,故C正确;
D.原电池中阳离子向正极移动,则电池工作时,溶液中的铝离子向正极移动,故D正确;
故选B.

 金牌教辅培优优选卷期末冲刺100分系列答案
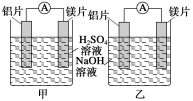
金牌教辅培优优选卷期末冲刺100分系列答案【题目】某研究性学习小组欲探究原电池的形成条件,按如图所示装置进行实验并得到下表实验结果:
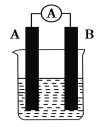
实验序号 | A | B | 烧杯中的液体 | 灵敏电流表指针是否偏转 |
1 | Zn | Zn | 乙醇 | 无 |
2 | Zn | Cu | 稀硫酸 | 有 |
3 | Zn | Cu | 稀硫酸 | 无 |
4 | Zn | Cu | 苯 | 无 |
5 | Cu | C | 氯化钠溶液 | 有 |
6 | Mg | Al | 氢氧化钠溶液 | 有 |
分析上述实验,回答下列问题:
(1)实验2中电流由________极流向________极(填“A”或“B”)。
(2)实验6中电子由B极流向A极,表明负极是________(填“镁”或“铝”)电极。
(3)实验5表明________(填字母序号,下同)。
A.铜在潮湿空气中不会被腐蚀
B.铜的腐蚀是自发进行的
(4)分析上表有关信息,下列说法不正确的是________。
A.金属活动顺序表中,活泼性强的金属一定作负极
B.失去电子的电极是负极
C.烧杯中的液体必须是电解质溶液
D.原电池中,浸入同一电解质溶液中的两个电极,是活泼性不同的两种金属(或其中一种非金属)