题目内容
(15分) 为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应。
乙同学发现在甲同学的实验中,褪色后的溶液里有少许淡黄色浑浊,推测在制得的乙炔中还可能含
有少量还原性的杂质气体,由此他提出必须先除去之,再与溴水反应。
请你回答下列问题:
(1)写出甲同学实验中两个主要的化学方程式 。
(2)甲同学设计的实验 (填能或不能)验证乙炔与溴发生加成反应,其理由是
(a)使溴水褪色的反应,未必是加成反应
(b)使溴水褪色的反应,就是加成反应
(c)使溴水褪色的物质,未必是乙炔
(d)使溴水褪色的物质,就是乙炔
(3)乙同学推测此乙炔中必定含有的一种杂质气体是 ,它与溴水反应的化学方程式是 ;在验证过程中必须全部除去。
(4)请你选用下列四个装置(可重复使用)来实现乙同学的实验方案,将它们的编号填入方框,并写出装置内所放的化学药品。
(a) (b) (c) (d)
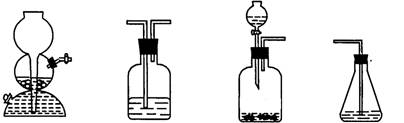
→ b → → d
(电石、水)( ) ( ) (溴水)
(5)为验证这一反应是加成而不是取代,丙同学提出可用pH试纸来测试反应后溶液的酸性,理由是 。
(共15分)(1)CaC2+2H2O C2H2↑+Ca(OH)2(2分)
C2H2↑+Ca(OH)2(2分)
HC≡CH+Br2 BrCH=CHBr(2分)(或HC≡CH+2Br2
BrCH=CHBr(2分)(或HC≡CH+2Br2 CHBr2CHBr2)
CHBr2CHBr2)
(2)不能 a、c(各1分)(3)H2S (1分)Br2+H2S===S↓+2HBr(2分)
(4) c b (CuSO4溶液)(CuSO1溶液)(各1分)
(5)如若发生取代反应,必定生成HBr,溶液酸性将会明显增强,故可用pH试纸验证。(1分)
【解析】
试题分析:(1)甲同学实验中两个主要的化学方程式分别是CaC2+2H2O C2H2↑+Ca(OH)2、HC≡CH+Br2
C2H2↑+Ca(OH)2、HC≡CH+Br2 BrCH=CHBr(或HC≡CH+2Br2
BrCH=CHBr(或HC≡CH+2Br2 CHBr2CHBr2)。
CHBr2CHBr2)。
(2)由于溴水还具有氧化性,所以使溴水褪色的物质不一定是乙炔,同样该反应也不一定是加成反应,因此答案选ac。
(3)褪色后的溶液里有少许淡黄色浑浊,说明反应中有单质S生成。因此含有的杂质气体可能是H2S,和溴水反应的方程式是Br2+H2S===S↓+2HBr。
(4)由于电石溶于水后不能保持块状,因此该装置不能用启普发生器,所以发生装置选择c。由于H2S能被硫酸铜溶液氧化,所以可用硫酸铜溶液除去乙炔中的H2S气体。为了验证是否完全除尽,还相应再一次通过盛有硫酸铜溶液的洗气瓶。
(5)因为如若发生取代反应,必定生成HBr,HBr溶于水溶液酸性将会明显增强,故可用pH试纸验证。
考点:考查乙炔的制备、除杂、性质等
点评:化学是一门以实验为基础的学科,所以有化学实验即科学探究之说法。纵观近几年高考,主要以考察探究性实验和物质制备实验为主。这些探究性和制备性实验的试题,综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。探究性实验的一般思路是:1.准确地把握实验目的;2.利用已学知识,分析如何实现这个目的--实验原理;3.结合实验材料,初步确定设计对策--实验方案。

 名校课堂系列答案
名校课堂系列答案



 _______________________________________________________________。
_______________________________________________________________。