题目内容
【题目】某强酸性溶液X中可能含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32﹣、SO32﹣、SO42﹣、Cl﹣、NO3﹣中的一种或几种,取该溶液进行连续实验,实验过程如图: 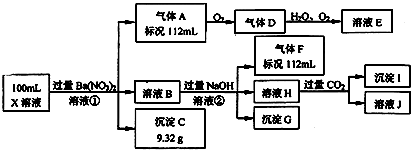
根据以上信息,回答下列问题:
(1)仅根据上述连续实验,不能确定溶液X中是否含有的阳、阴离子分别是(填离子符号), 能证明该阴离子是否存在的简单实验操作为 .
(2)①中生成气体A的离子方程式为 .
(3)若②中所用氢氧化钠的浓度为2mol/L,当加入l0mL时开始产生沉淀,55mL时沉淀的量达到最大值为0.03mol,继续滴加沉淀的量保持不变,随后再滴加沉淀部分溶解,到60mL时沉淀的量降为0.025mol且保持不变,则原溶液中c(Fe3+)为mol/L、c(Cl﹣)为mol/L(若有些离子不存在,请填“0”).
【答案】
(1)Fe3+、Cl﹣;取少量溶液X,滴加足量的Ba(NO3)2溶液,静置,取上层清液,滴加硝酸酸化的AgNO3溶液,若有白色沉淀产生,则存在Cl﹣,若无白色沉淀产生,则不存在Cl﹣
(2)3Fe2++4H++NO3﹣═3Fe3++NO↑+2H2O
(3)0.1;0.4
【解析】解:强酸性溶液中一定不会存在CO32﹣、SO32﹣离子;加入过量硝酸钡生成沉淀,则该沉淀C9.32g为BaSO4,说明溶液中含有SO42﹣离子,根据硫酸钡的质量可以计算硫酸根离子的物质的量为 ![]() =0.04mol,浓度是
=0.04mol,浓度是 ![]() =0.4mol/L,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,则一定为Fe2+离子,根据NO的体积可以计算亚铁离子的量,溶液B中加入过量NaOH溶液,沉淀G只为Fe(OH)3,生成气体F,则F为NH3,112mL氨气的物质的量是0.005mol,根据氮元素守恒,溶液中含有NH4+离子物质的量是0.005mol,浓度是0.05mol/L;溶液H中通入CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,再根据离子共存知识,溶液中含有Fe2+离子,则一定不含NO3﹣离子,含有SO42﹣离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl﹣,(1)根据以上分析可知,溶液中不能确定的阳离子为Fe3+,溶液中不能确定的阴离子为Cl﹣,取少量溶液X,滴加足量的Ba(NO3)2溶液,静置,取上层清液,滴加硝酸酸化的AgNO3溶液,若有白色沉淀产生,则存在Cl﹣,若无白色沉淀产生,则不存在Cl﹣,
=0.4mol/L,生成气体A,A连续氧化生成D和E,则A为NO,D为NO2,E为HNO3,说明溶液中含有还原性离子,则一定为Fe2+离子,根据NO的体积可以计算亚铁离子的量,溶液B中加入过量NaOH溶液,沉淀G只为Fe(OH)3,生成气体F,则F为NH3,112mL氨气的物质的量是0.005mol,根据氮元素守恒,溶液中含有NH4+离子物质的量是0.005mol,浓度是0.05mol/L;溶液H中通入CO2气体,生成沉淀I,则I为Al(OH)3,H为NaOH和NaAlO2,说明溶液中含有Al3+离子,再根据离子共存知识,溶液中含有Fe2+离子,则一定不含NO3﹣离子,含有SO42﹣离子就一定不含Ba2+离子,不能确定是否含有的离子Fe3+和Cl﹣,(1)根据以上分析可知,溶液中不能确定的阳离子为Fe3+,溶液中不能确定的阴离子为Cl﹣,取少量溶液X,滴加足量的Ba(NO3)2溶液,静置,取上层清液,滴加硝酸酸化的AgNO3溶液,若有白色沉淀产生,则存在Cl﹣,若无白色沉淀产生,则不存在Cl﹣,
所以答案是:Fe3+、Cl﹣;取少量溶液X,滴加足量的Ba(NO3)2溶液,静置,取上层清液,滴加硝酸酸化的AgNO3溶液,若有白色沉淀产生,则存在Cl﹣,若无白色沉淀产生,则不存在Cl﹣;(2)中得到的气体A是NO,Fe2+离子被氧化为Fe3+离子,NO3﹣离子被还原为NO气体,反应的离子方程式为:3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O,
所以答案是:3Fe2++4H++NO3﹣═3Fe3++NO↑+2H2O;(3)根据反应:3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O,得到112mL0.005molNO,Fe2+的物质的量是0.015mol,所以原溶液中c(Fe2+)= ![]() =0.15mol/L,加入氢氧化钠是60ml时,沉淀的量降为0.025mol,即氢氧化铁的物质的量是0.025mol,根据铁元素守恒,所以Fe3+的物质的量是0.01mol,所以原溶液中c(Fe3+)=
=0.15mol/L,加入氢氧化钠是60ml时,沉淀的量降为0.025mol,即氢氧化铁的物质的量是0.025mol,根据铁元素守恒,所以Fe3+的物质的量是0.01mol,所以原溶液中c(Fe3+)= ![]() =0.1mol/L,硫酸根离子的物质的量为
=0.1mol/L,硫酸根离子的物质的量为 ![]() =0.04mol,浓度是
=0.04mol,浓度是 ![]() =0.4mol/L,NH4+离子物质的量是0.005mol,浓度是0.05mol/L,Al3+的物质的量是0.005mol,浓度是0.05mol/L,
=0.4mol/L,NH4+离子物质的量是0.005mol,浓度是0.05mol/L,Al3+的物质的量是0.005mol,浓度是0.05mol/L,
根据反应:3Fe2++NO3﹣+4H+=3Fe3++NO↑+2H2O,可知参加反应H+为0.005mol×4=0.02mol,加入氢氧化钠消耗H+为0.01L×2mol/L=0.02mol,故原溶液中H+为0.02mol+0.02mol=0.04mol,由于2c(Fe2+)+3c(Fe3+)+3c(Al3+)+c(NH4+)=(2×0.15+3×0.1+3×0.05+0.05)mol/L=0.8mol/L,2c(SO42﹣)=0.8mol/L,原溶液中含有Cl﹣,根据电荷守恒,c(Cl﹣)=c(H+)= ![]() =0.4mol/L,
=0.4mol/L,
所以答案是:0.1;0.4.