题目内容
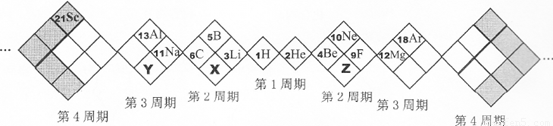
某同学设计如下元素周期表,以下说法正确的是( )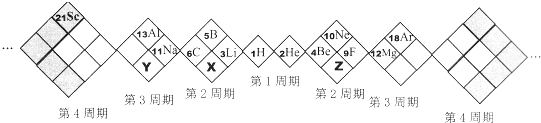

| A、X、Y、Z元素分别为N、P、O | B、白格中都是主族元素,灰格中都是副族元素 | C、原子半径:Z>X>Y | D、X、Y、Z的气态氢化物中最稳定的是:Z的氢化物 |
分析:A、根据该同学涉及元素周期表的形式和位置可知:X的原子序数为7,Z的原子序数为8,Y的原子序数为15,因此X为N,Z为O,Y为P;
B、白格中的He、Ne、Ar不属于主族元素;
C、根据同周期自左到右原子半径逐渐减小,同主族自上而下原子半径逐渐增大判断;
D、根据非金属性越强,形成的气态氢化物越稳定判断.
B、白格中的He、Ne、Ar不属于主族元素;
C、根据同周期自左到右原子半径逐渐减小,同主族自上而下原子半径逐渐增大判断;
D、根据非金属性越强,形成的气态氢化物越稳定判断.
解答:解:A、根据该同学涉及元素周期表的形式和位置可知:X的原子序数为7,Z的原子序数为8,Y的原子序数为15,因此X为N,Z为O,Y为P,故A正确;
B、白格中的稀有气体He、Ne、Ar不属于主族元素,故B错误;
C、同周期自左到右原子半径逐渐减小,原子半径N>O,同主族自上而下原子半径逐渐增大,原子半径P>N,因此原子半径P>N>O,故C错误;
D、非金属性:O>N>P,非金属性越强,形成的气态氢化物越稳定,因此形成的气态氢化物最稳定的是H2O,故D正确;
故选:AD.
B、白格中的稀有气体He、Ne、Ar不属于主族元素,故B错误;
C、同周期自左到右原子半径逐渐减小,原子半径N>O,同主族自上而下原子半径逐渐增大,原子半径P>N,因此原子半径P>N>O,故C错误;
D、非金属性:O>N>P,非金属性越强,形成的气态氢化物越稳定,因此形成的气态氢化物最稳定的是H2O,故D正确;
故选:AD.
点评:本题通过该同学设计的元素周期表推知X、Y、Z的原子序数,从而确定所代表的元素种类,侧重于考查元素周期律中原子半径大小、非金属性的强弱等规律,难度中等,变的是元素周期表的形式,不变的是元素周期律.

练习册系列答案
相关题目
下表是元素周期表的一部分,表中所列字母分别代表一种元素。
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
| 一 | A | | | | | | |
| 二 | | | | B | C | D | E |
| 三 | F | | G | H | | I | K |
| 四 | J | | | | | | L |
(1)上述元素中非金属性最强的是_____(填元素符号),J的氢氧化物的电子式:________。
(2)E、L两元素核电荷数之差是 。
(3)某同学设计如下实验验证B、H非金属性的相对强弱。(酸性:H2SO3 >H2CO3)

①检查装置气密性,加药品后,打开a,然后滴入浓硫酸加热,铜与浓硫酸反应的化学方程式是 。
②装置A中的试剂可以是 。
a.Na2CO3溶液 b.溴水 c.酸性KMnO4溶液 d.NaOH溶液
③能说明碳的非金属性比硅强的实验现象是 。
④若将第一支试管中试剂换为H2S溶液,试管中有浅黄色浑浊出现,该反应的化学方程式是 ;若换成新制氯水,则反应的离子方程式为 。
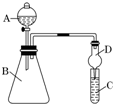 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.