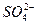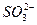题目内容
方案1 :向废液中加入过量的铁粉,充分反应后,过滤。 在所得滤渣中加入足量的盐酸,充分反后,再过滤即得到铜。
方案1中涉及的四种阳离子的氧化牲由强到弱的顺序为:_____________________过滤操作时,需要用到的玻璃仪器是:______________________
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的Cu已全部析出。
方案2中铜作______极,所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)_______________________________________________________ 另一电极所发生的电极反应为_____________________________ 方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为: ______________________
本题以废液中回收Cu为素材,将氧化还原反应知识和电化学知识紧密的结合起来,方案1中同时考查了过滤操作。方案2是用电解的方法回收Cu,用铜和石墨作电极,铜要做阴极,阳离子在阴极得电子,因溶液中含有Fe3+、Cu2+、H+、Fe2+,所以存在得电子顺序问题,由方案1中知氧化性由强到弱的顺序为Fe3+>Cu2+>H+>Fe2+,故得电子顺序为Fe3+>Cu2+>H+>Fe2+,由题意知Fe3+、Cu2+、H+分别先后在阴极得电子。最后一问还从环保和经济方面考查了方案的不足。

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案
相关题目