题目内容
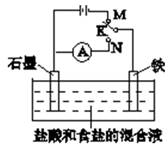
铅蓄电池反应原理为:Pb(s)+PbO2(s) +2H2SO4(aq)  2PbSO4(s)+2H2O(l),下列说法正确的是
2PbSO4(s)+2H2O(l),下列说法正确的是
 2PbSO4(s)+2H2O(l),下列说法正确的是
2PbSO4(s)+2H2O(l),下列说法正确的是| A.放电时,负极的电极反应式为:Pb – 2e-=Pb2+ |
| B.放电时,正极得电子的物质是PbO2 |
| C.充电时,电解质溶液中硫酸浓度减小 |
| D.充电时,阴极的电极反应式为:PbSO4 – 2e- +2H2O=PbO2+4H++SO42- |
B
试题分析:A、根据总方程式可知,放电时,负极的电极反应式为:Pb+SO42?– 2e-=PbSO4,错误;B、放电时,正极上PbO2得电子,正确;C、根据总方程式,充电时生成H2SO4,所以硫酸的浓度增大,错误;D、充电时,阴极发生得电子反应,错误。

练习册系列答案
相关题目

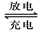 2PbSO4+2H2O
2PbSO4+2H2O