题目内容
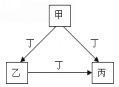
【题目】海水是巨大的资源宝库,海水开发利用的部分过程如图所示。

(1)操作1的名称是____,进行该操作时所需的玻璃仪器为烧杯、____;
(2)上述流程所得粗盐中含有的少量Ca2+、Mg2+、SO42-等杂质离子常用①Na2CO3溶液②BaCl2溶液③NaOH溶液④稀盐酸来进行除去,试剂的加入顺序为③____(填试剂序号);
(3)上述流程所得苦卤中通入Cl2后的溶液中溴的浓度极低,所以工业上一般要向该溶液中通入热空气,吹出的溴蒸气用二氧化硫水溶液吸收,再向吸收液中通入氯气得到较高浓度的溴水,写出溴与二氧化硫水溶液反应的化学方程式____________。
【答案】 过滤 玻璃棒、普通漏斗 ②①④ SO2+Br2+2H2O=2HBr+H2SO4
【解析】(1)操作1得到氢氧化镁沉淀,其名称是过滤,进行该操作时所需的玻璃仪器为烧杯、玻璃棒、普通漏斗;(2)Ca2+用碳酸钠除去,Mg2+用氢氧化钠除去,SO42-用氯化钡除去,最后过滤后在滤液中加入盐酸酸化。但由于过量的氯化钡要用碳酸钠来除,所以碳酸钠必需放在氯化钡的后面,而氢氧化钠可以随意调整,所以试剂的加入顺序为③②①④;(3)溴与二氧化硫水溶液反应的化学方程式为SO2+Br2+2H2O=2HBr+H2SO4。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目