题目内容
在温度和压强不变时,1LNO2高温分解(2NO2?2NO+O2),达到平衡时体积变为1.2L,这时NO2的转化率为( )
分析:根据体积变化,利用方程式差量法计算参加反应的NO2的体积,再根据NO2的转化率=
×100%计算.
| 反应的NO2的体积 |
| 投入的NO2的体积 |
解答:解:令参加反应的NO2的体积为V,则:
2NO2?2NO+O2 体积增大△V
2 (2+1)-2=1
V 1.2L-1L=0.2L
所以:2:1=V:0.2L
解得:V=0.4L
所以NO2的转化率=
×100%=40%
故选A.
2NO2?2NO+O2 体积增大△V
2 (2+1)-2=1
V 1.2L-1L=0.2L
所以:2:1=V:0.2L
解得:V=0.4L
所以NO2的转化率=
| 0.4L |
| 1L |
故选A.
点评:考查化学平衡的有关计算,难度中等,注意差量法的理解与利用.

练习册系列答案
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
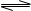 在温度和压强不变时,1LNO2高温分解(
在温度和压强不变时,1LNO2高温分解( )达到平衡时体积变为1.3L,这时NO2的转化率为( )
)达到平衡时体积变为1.3L,这时NO2的转化率为( )
| A.40% | B.20% | C.60% | D.5% |
 )达到平衡时体积变为1.3L,这时NO2的转化率为( )
)达到平衡时体积变为1.3L,这时NO2的转化率为( )