题目内容
工业上常用铁质容器盛装冷浓酸。为研究铁质材料与热浓硫酸的反应,某学习小组进行了以下探究活动:
[探究一]
(1)将已去除表面氧化物的铁钉(碳素钢)放入冷浓硫酸中,10分钟后移人硫酸铜溶液中,片刻后取出观察,铁钉表面无明显变化,其原因是 。
(2)另称取铁钉6.0g放入15.0ml.浓硫酸中,加热,充分应后得到溶液X并收集到气体Y。
①甲同学认为X中除![]() 外还可能含有
外还可能含有![]() 。若要确认其中的
。若要确认其中的![]() ,应先用 选填序号)。
,应先用 选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性![]() 溶液
溶液
②乙同学取336ml(标准状况)气体Y通入足量溴水中,发生反应:
![]()
然后加入足量![]() 溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中
溶液,经适当操作后得干燥固体2.33g。由于此推知气体Y中![]() 的体积分数为 。
的体积分数为 。
[探究二]
分析上述实验中![]() 体积分数的结果,丙同学认为气体Y中还可能含量有
体积分数的结果,丙同学认为气体Y中还可能含量有![]() 和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
和Q气体。为此设计了下列探究实验状置(图中夹持仪器省略)。
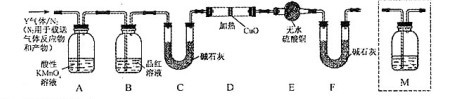
(3)装置B中试剂的作用是 。
(4)认为气体Y中还含有Q的理由是 (用化学方程式表示)。
(5)为确认Q的存在,需在装置中添加M于 (选填序号)。
a. A之前 b.A-B间 c.B-C间 d.C-D间
(6)如果气体Y中含有![]() ,预计实验现象应是 。
,预计实验现象应是 。
(7)若要测定限定体积气体Y中![]() 的含量(标准状况下约有28ml
的含量(标准状况下约有28ml ![]() ),除可用测量
),除可用测量![]() 体积的方法外,可否选用质量称量的方法?做出判断并说明理由 。
体积的方法外,可否选用质量称量的方法?做出判断并说明理由 。
(1)铁钉表面被钝化(或其它合理答案)
(2)①d ②66.7%(或其他合理答案)
(3)检验SO2是否除尽
![]()
(5)c
(6)D中固体由黑变红和E中固体由白变蓝
(7)否,用托盘天平无法称量D或E的差量 可,用分析天平称量D或E的差量
解析:
本题为对化学实验的考查。 对Fe2+的检验可利用Fe2+的还原性,用酸性高锰酸钾溶液来检验。利用硫元素的守恒,结合关系式:SO2→BaSO4求出SO2的体积分数:![]() =66.7%。根据铁钉(或碳素钢)中含有碳元素,推断所的气体中可能含有二氧化碳,结合图中设计装置的目的,可知检验二氧化碳的方法是首先将二氧化硫除去→确认二氧化硫已经完全除去→碱石灰吸收→称量碱石灰质量是否增加→确认是否含有二氧化碳,故吸收二氧化碳之前应除去其中的水蒸气,即在B、C间加入干燥装置。对于氢气的检验则可通过与灼热氧化铜的反应现象和对产物水的验证来实现。本题涉及的实验质量、体积都非常小,其质量数据测量要求远远超过了中学实验中使用的托盘天平的精确度,故(7)中不能用测量质量法来测定。
=66.7%。根据铁钉(或碳素钢)中含有碳元素,推断所的气体中可能含有二氧化碳,结合图中设计装置的目的,可知检验二氧化碳的方法是首先将二氧化硫除去→确认二氧化硫已经完全除去→碱石灰吸收→称量碱石灰质量是否增加→确认是否含有二氧化碳,故吸收二氧化碳之前应除去其中的水蒸气,即在B、C间加入干燥装置。对于氢气的检验则可通过与灼热氧化铜的反应现象和对产物水的验证来实现。本题涉及的实验质量、体积都非常小,其质量数据测量要求远远超过了中学实验中使用的托盘天平的精确度,故(7)中不能用测量质量法来测定。
【误区警示】本题第(6)小问容易漏答盛无水硫酸铜的干燥管中现象而丢分(因为能使氧化铜还原的气体也可能是一氧化碳)。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案