题目内容
【题目】镧系金属元素铈(Ce)常见有+3、+4两种价态,铈的合金耐高温,可以用来制造喷气推进器零件。请回答下列问题:
(1)雾霾中含有的污染物NO可以被含Ce4+的溶液吸收,生成NO2-、NO3- 物质的量之比为1:1,试写出该反应的离子方程式:______________________。
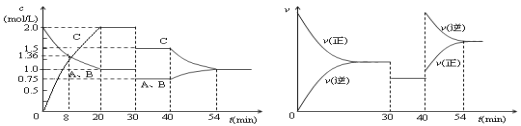
(2)用电解的方法可将上述吸收液中的NO2- 转化为稳定的无毒气体,同时生成Ce4+,其原理如下图所示。
①无毒气体从电解槽的_______(填字母代号)口逸出。
②每生成1mol无毒气体,同时可再生Ce4+ ______mol
(3)铈元素在自然界中主要以氟碳铈矿的形式存在,其主要化学成分为 CeFCO3。工业上利用氟碳铈矿提取CeCl3的一种工艺流程如下图所示
![]()

①焙烧过程中发生的主要反应的氧化剂和还原剂的物质的量之比为__________。
②向Ce(BF4)3中加入KCl溶液的目的是_________________________________。
③加热CeCl3·6H2O和NH4Cl的固体混合物可得固体无水CeCl3,其中NH4Cl的作用是_________________________________________________________________。
【答案】4Ce4++2NO+3H2O=4Ce3++NO![]() +NO
+NO![]() +6H+ c 6 1:4 避免Ce3+以Ce(BF4)3形式沉淀而损失(或将Ce3+全部转化为CeCl3,提高产率) NH4Cl固体分解产生的HCl可抑制CeCl3的水解
+6H+ c 6 1:4 避免Ce3+以Ce(BF4)3形式沉淀而损失(或将Ce3+全部转化为CeCl3,提高产率) NH4Cl固体分解产生的HCl可抑制CeCl3的水解
【解析】
(1)NO可以被含Ce4+的溶液吸收,生成NO2-、NO3-,反应过程中N化合价升高,Ce化合价则降低,氧化剂为Ce4+,还原剂为NO;
(2)①采用电解法将NO2-转化为无毒物质,同时再生Ce4+,过程中Ce化合价升高,为失电子反应,电解池中阳极处的反应为失电子反应;
②电解池阴极发生的反应为物质得到电子,发生还原反应,根据装置图,H+到阴极参加反应,电解将NO2-转化为无毒物质,可判断为N2,据此写出电极反应;
(3)①焙烧过程中,CeFCO3转化生成CeO2和CeF4,焙烧过程O2参加反应,据此写出主要反应的方程式;
②向Ce(BF4)3中加入KCl溶液生成CeCl3和KBF,防止生成Ce(BF4)3沉淀;
③加热CeCl36H2O和NH4Cl的固体混合物可得固体无水CeCl3,考虑到Ce是镧系重金属,重金属离子会水解,NH4Cl的作用是调控溶液为酸性,抑制CeCl3的水解。
(1)雾霾中含有大量的污染物NO,可以被含Ce4+的溶液吸收,生成NO2-、NO3- 物质的量之比为1:1,,反应的离子方程式为4Ce4++2NO+3H2O=4Ce3++NO2-+NO3-+6H+。
因此,本题正确答案是:4Ce4++2NO+3H2O=4Ce3++NO2-+NO3-+6H+;
(2)①电解池中Ce3+在阳极失去电子转化为Ce4+,因此Ce4+从电解槽的a口流出,阴极是NO2-得到电子转化为N2,则无毒气体从电解槽的c口逸出。
②阳极电极反应式为:Ce3+-e-= Ce4+,阴极电极反应式为:2NO2-+8H++6e-=N2↑+4H2O,每生成1mol无毒气体,同时可再生6mol Ce4+。
因此,本题正确答案是:c ;6;
(3)①根据流程图可知焙烧过程中CeFCO3与氧气反应生成CeO2、CeF4和CO2,反应方程式为4CeFCO3+O2![]() 3CeO2+ CeF4+4CO2,其中氧化剂O2和还原剂CeFCO3的物质的量之比为1:4。
3CeO2+ CeF4+4CO2,其中氧化剂O2和还原剂CeFCO3的物质的量之比为1:4。
②避免Ce3+以Ce(BF4)3形式沉淀而损失或将Ce3+全部转化为CeCl3,提高产率,故向Ce(BF4)3中加入KCl溶液。
③加热CeCl3·6H2O和NH4Cl的固体混合物可得固体无水CeCl3,其中NH4Cl的作用是NH4Cl固体分解产生的HCl可抑制CeCl3的水解。
因此,本题正确答案是:1:4;避免Ce3+以Ce(BF4)3形式沉淀而损失(或将Ce3+全部转化为CeCl3,提高产率) ;NH4Cl固体分解产生的HCl可抑制CeCl3的水解。

 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案【题目】以下是25 ℃时几种难溶电解质的溶解度:
难溶电解质 | Mg(OH)2 | Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
溶解度/g | 9×10-4 | 1.7×10-6 | 1.5×10-4 | 3.0×10-9 |
在无机化合物的提纯中,常利用难溶电解质的溶解平衡原理除去某些杂质离子。例如:
①为除去氯化铵中的杂质Fe3+,先将混合物溶于水,再加入一定量的试剂反应,过滤结晶即可;
②为除去氯化镁晶体中的杂质Fe3+,先将混合物溶于水,加入足量的氢氧化镁,充分反应,过滤结晶即可;
③为除去硫酸铜晶体中的杂质Fe2+,先将混合物溶于水,加入一定量的H2O2,将Fe2+氧化成Fe3+,调节溶液的pH=a,过滤结晶即可。
请回答下列问题:
(1)上述三种除杂方案都能够达到很好的效果,Fe3+、Fe2+都被转化为__________________(填化学式)而除去。
(2)①中加入的试剂应该选择__________为宜,其原因是______________________________。
(3)②中除去Fe3+所发生的总反应的离子方程式为____________________________________。
(4)已知Fe(OH)3的Ksp=1×10-35 ;化学上通常认为残留在溶液中离子浓度小等于1×10-5mol/L时,沉淀完全。方案③中a最小值为________________。
(5)下列与方案③相关的叙述中,正确的是___________________________(填字母)。
A.H2O2是绿色氧化剂,在氧化过程中不引进杂质,不产生污染
B.将Fe2+氧化为Fe3+的主要原因是Fe(OH)2沉淀比Fe(OH)3沉淀较难过滤
C.调节溶液pH=a可选择的试剂是氢氧化铜或碱式碳酸铜
D.Cu2+可以大量存在于pH=a的溶液中
E.在pH>a的溶液中Fe3+一定不能大量存在