题目内容
【题目】某课外小组分别用下图所示装置对原电池和电解原理进行实验探究。
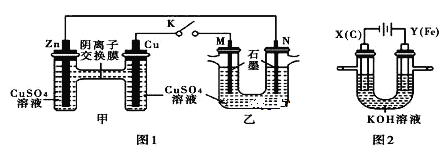
请回答:
用图 1 所示装置进行第一组实验(K 闭合)
(1)Zn 极为_____极。实验过程中,甲中 SO42-________________(填“从左向右”、“从右向左”或“不”)移动;反应初期乙中 N 极发生的电极反应为_________________________________。
(2)反应一段时间后,打开 K,向乙中加入 0.1mol Cu(OH)2 后恰好复原,则上述电解过程中转移的电子数为______________NA。用图 2 所示装置进行第二组实验。实验中两极均有气体产生,且 Y 极区产生 FeO42-,溶液呈浅紫红色。
(3)Y 极上 Fe 变为FeO42-的电极反应式为________________
(4)电解过程中,X 极区溶液的 pH_____(填“增大” 、“减小”或“不变”)。若在 X 极收集到 672 mL 气体,在 Y 极收集到 168 mL 气体(均为标准状况),则 Y 电极质量减少_____g。
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应式为:2K2FeO4+3Zn = Fe2O3 +ZnO+2K2ZnO2 该电池正极发生的电极反应方程式为_____。
【答案】负 从右向左 Cu2++2e-==Cu 0.4 Fe-6e-+8OH-==FeO42-+4H2O 增大 0.28 2FeO42- +6e- +5H2O = Fe2O3 +10OH-
【解析】
(1)在原电池反应中,活动性:负极>正极;SO42-向正电荷多的区域移动;在电解池中,阳极发生氧化反应,阴极发生还原反应;
(2) 0.1mol Cu(OH)2的作用相当于0.1molCuO和0.1molH2O,加入0.1mol Cu(OH)2的溶液可复原,说明发生反应的物质有CuSO4、水,根据二者的物质的量计算电子转移数目;
(3)Fe是活性电极,阳极,发生氧化反应。结合溶液的酸碱性书写电极反应式;
(4)C作阴极,发生还原反应,根据溶液中c(H+)的改变判断pH变化;
(5)在原电池中,正极上发生还原反应,结合总反应方程式及溶液的酸碱性,可得正极电极反应式。
(1)由于金属活动性Zn>Cu,所以Zn作负极,发生反应:Zn-2e-=Zn2+,Zn2+进入溶液,使负极附近溶液的正电荷增多,根据异种电荷相互吸引,可知甲中SO42-向负极Zn电极区域移动,即从右向左移动;Cu活动性比Zn弱,作原电池的正极。右边的乙池为电解池,其中M电极与原电池的正极相连,作阳极,N电极与原电池的负极相连,作阴极,在阴极上发生还原反应,根据CuSO4溶液中阳离子的活动性:Cu2+>H+,所以在该电极上发生的反应为Cu2++2e-=Cu。
(2) 加入0.1mol Cu(OH)2的溶液可复原,说明发生反应的物质有CuSO4、水,0.1mol Cu(OH)2的作用相当于有0.1molCuO和0.1molH2O反应;n(CuSO4)=0.1mol,转移电子的物质的量为0.1×2=0.2mol,又有0.1mol的水电解,其转移电子的物质的量为0.1×2=0.2mol,因此共转移电子的物质的量为0.4mol电子数目为0.4NA;
(3)在图2电解池中,Fe作阳极,失去电子,发生氧化反应,由于溶液显碱性,所以Y 极上 Fe 变为FeO42-的电极反应式为Fe-6e-+8OH-=FeO42-+4H2O;
(4)在阴极X电极上,溶液中的H+不断放电产生氢气,使阴极负极溶液中c(OH-)增大,因此附近溶液的pH增大;在X电极发生反应:2H++2e-=H2↑,产生氢气,其物质的量n(H2)=0.672L÷22.4L/mol=0.03mol,在Y电极,首先发生反应:Fe-6e-+8OH-=FeO42-+4H2O,然后发生反应4OH--4e-=O2↑+2H2O,产生氧气,析出氧气的物质的量n(O2)=0.168L÷22.4L/mol=0.0075mol。由于同一闭合回路中电子转移数目相等,所以2n(H2)=4n(O2)+6n(Fe),2×0.03mol=4×0.0075mol+6n(Fe),解得n(Fe)=0.005mol,则Y电极减少的Fe的质量为m(Fe)=0.005mol×56g/mol=0.28g;
(5)在正极上高铁酸根离子获得电子被还原,发生还原反应,电极反应式是:2FeO42- +6e- +5H2O = Fe2O3 +10OH-。

【题目】验证牺牲阳极的阴极保护法,实验如下(烧杯内均为经过酸化的3%NaCl溶液)。
① | ② | ③ |
|
|
|
在Fe表面生成蓝色沉淀 | 试管内无明显变化 | 试管内生成蓝色沉淀 |
下列说法不正确的是
A. 对比②③,可以判定Zn保护了Fe
B. 对比①②,K3[Fe(CN)6]可能将Fe氧化
C. 验证Zn保护Fe时不能用①的方法
D. 将Zn换成Cu,用①的方法可判断Fe比Cu活泼