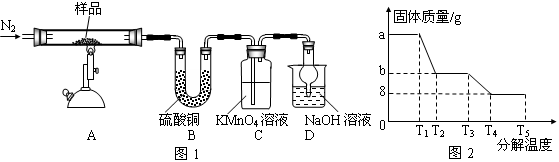
题目内容
氧化铜矿石含有CuO和Cu2(OH) 2CO3,还含有Fe2O3、FeO和SiO2等。铜、铁是畜禽所必需的微量元素。某饲料厂联合生产硫酸铜和硫酸亚铁工艺流程如下:
(1)氧化铜矿石粉碎的目的是 。
(2)写出“酸浸”中Cu2(OH) 2CO3发生反应的离子方程式 。
(3)“中和/过滤”中加入CaCO3的目的是 。
(4)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(5)加入铁屑的作用是 、 。
(6)下表和下图为“烘干粉碎”的试验结果。
| 序号 | t/h | t/℃ | m/g | x |
| 1 | 3 | 80 | 5 | 4 |
| 2 | 3 | 160 | 10 | 1 |
| 3 | 4 | 160 | 10 | 0.8 |
| 4 | 4 | 160 | 5 | 0 |
| 5 | 5 | 80 | 5 | 3 |
| 6 | 5 | 160 | 15 | 1 |
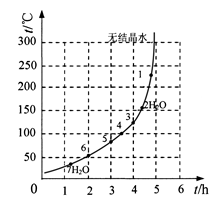
硫酸亚铁干燥曲线图
表中,m为CuSO4·5H2O晶体的质量,x为干燥后所得晶体中结晶水的个数。据此可确定由CuSO4·5H2O和FeSO4·7H2O脱水得流程中所示产品的适宜工艺条件分别为 , (分别指出两条件的温度和时间)。
19.(15分)
(1)增大接触面积,加快化学反应速率。(2分)
(2)Cu2(OH) 2CO3+4H+=2Cu2++3H2O+CO2↑(2分)
(3)适当降低溶液的酸性,使Fe3+水解成沉淀而除出(2分)
(4)烧杯、玻璃棒、漏斗(3分,各1分)
(5)使母液中Fe3+转化为Fe2+(1分)、除去Cu2+,提高硫酸亚铁晶体的纯度(1分,
其他合理答案也给分)。
(6)160℃、3h,125(±5)℃、4.0h (4分,每空2分)
解析试题分析:(1)根据加快化学反应速率的方法,氧化铜矿石粉碎,增大与硫酸的接触面积,加快了两者反应的速率。
(2)写离子方程式不仅要质量守恒定量,还要符合电荷守恒定量,先确定反应物是Cu2(OH) 2CO3和H+,酸和盐的反应应该生成别一种酸和别一种盐,所以生成物是Cu2+和H2CO3,H2CO3不稳定分解成H2O+CO2。
(3)该实验的目的是联合生产硫酸铜和硫酸亚铁,硫酸铜通过滤液蒸发结晶,烘干粉碎可以制取,因此硫酸亚铁由另一条线获得,经“中和/过滤”所得滤渣应该是含铁的沉淀——Fe(OH)3,由于前一步只加入KMnO4,目的是将溶液中的Fe2+氧化为Fe3+,Fe3是弱碱阳离子,水解后生成Fe(OH)3和H+,根据题目所给条件“中和/过滤”,很容易想到用CaCO3中和过量的硫酸,降低了溶液的酸性, 促进Fe3+水解成沉淀Fe(OH)3而除出。
(4)过滤操作需要使用的玻璃仪器有烧杯、玻璃棒、漏斗
(5)溶液中的大部分Fe3+水解成沉淀Fe(OH)3,还有少量Cu2+和Fe3+存在于滤液中,加入铁屑不仅使母液中Fe3+转化为Fe2+,而且同时除去Cu2+,提高硫酸亚铁晶体的纯度,不会引入新的杂质离子。
(6)根据表2和图6可知,由CuSO4·5H2O脱水制CuSO4·H2O,那么X应该是1,温度应选160℃,时间选3h,由FeSO4·7H2O脱水制FeSO4·3H2O,在图上找到3对应的坐标为(125℃±5,4.0h)。
考点:本题以工艺流程为基础,考元素及化合物、化学实验基本操作、化学图像识别等相关知识。

 阅读快车系列答案
阅读快车系列答案下列有关实验的说法正确的是
| A.用pH试纸蘸取NaOH溶液,立刻与比色卡对比,测定NaOH溶液的Ph |
B.通过观察图中导管水柱的变化,验证铁钉生锈的原因主要是吸氧腐蚀 |
| C.均不能采取将溶液直接蒸干的方法制得AIC13、A12(SO4)3、FeC13、Fe2(SO4)3 |
| D.滴定用的滴定管、锥形瓶和配制一定物质的量浓度溶液用的容量瓶,使用前均要润洗 |
(一)实验室用Na2CO3·10H2O配制500ml 0.10mol·L-1的Na2CO3溶液,填空并请回答下列问题:
(1)根据实验要求填表:
| 应量取Na2CO3·10H2O的质量/g | 应选用容量瓶的规格/mL | 除容量瓶外还需要的其它玻璃仪器 |
| | | |
(2)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次) ;
A.用适量水洗涤烧杯2—3次,洗涤液均注入容量瓶中,振荡。
B.用托盘天平准确称量所需Na2CO3·10H2O的质量,倒入烧杯中,再加入适量水,用玻璃棒慢慢搅动,使其溶解(需要时可加热)。
C.将已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1—2cm处
(3)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?若没有进行A操作 ;若加蒸馏水时不慎超过了刻度 ;若定容时俯视刻度线 。
(二)喷泉实验是一种常见的自然现象,其产生原因是存在压强差。试根据下图,回答下列问题:

(1)在图A的烧瓶中充满干燥气体,胶头滴管及烧杯中分别盛有液体。下列组合中不可能形成喷泉的是( )。
A.HCl和H2O B.Cl2和NaOH溶液
C.HCl和汽油 D.CO2和NaOH溶液
(2)在图B的锥形瓶中,分别加入足量的下列物质,反应后可能产生喷 泉的是( )
A.Cu与稀盐酸 B.NaHCO3与NaOH溶液
C.CaCO3与稀硫酸 D.NH4HCO3与稀盐酸
(3)在图B的锥形瓶外放一水槽,锥形瓶中加入酒精,水槽中加入冷水后,再加入足量的下列物质,结果也产生了喷泉。水槽中加入的物质不可能是( )。
A.浓硫酸 B.生石灰 C.硝酸铵 D.烧碱
(4)比较图A和图B两套装置,以产生喷泉的原理来分析,图A是_______上部烧瓶内压强;城市中常见的人造喷泉及火山爆发的原理与上述________(填图A或图B)装置的原理相似。
作为高中生,学会利用我们课堂上学到的知识来解决生活中的一些问题,是我们学习的重要目的之一。重庆一中某化学实验兴趣小组,一行四人,利用实验室老师提供的基本仪器和药品,自行购置了鸡蛋,食醋等生活用品,进行了如下探究。
I. 甲同学老家在山西,对儿时在家乡品尝到的山西老陈醋的滋味记忆犹新,跟随父母来到重庆后,总是觉得超市买到的醋不如儿时的味道,查阅相关资料后,得知以下信息:
①醋分两种,酿造醋和配制醋。正宗的老陈醋必须经长久时间酿造才得此美味,市场上多充斥着工业醋酸加水勾兑的配制醋。
②酿造醋国家标准为醋酸含量必须大于3.50 g/100mL,而配制醋国家标准仅为1.50 g~3.50g/100mL。
③在老师的帮助下,测定了超市购买的食醋中,醋酸的物质的量浓度为0.75mol/L。
(1)请帮助张同学计算从超市购买的食醋中醋酸含量为_______g/100mL,属于____________醋(填“酿造”或“配制”)。(提示:醋酸摩尔质量为60g/mol)
(2)请写出醋酸与鸡蛋壳(主要成分为CaCO3)反应的离子方程式_______________________________。
II. 下图是重庆一中化学实验室浓盐酸试剂标签上的部分内容。乙同学现用该浓盐酸配100mL1mol/L的稀盐酸。可供选用的仪器有:①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平;⑦玻璃棒。请回答下列问题:
(1)配制稀盐酸时,还缺少的仪器有 ;
(2)经计算,配制100mL1mol/L的稀盐酸需要用量筒量取上述浓盐酸的体积为 mL(保留小数点后一位);
(3)对所配制的稀盐酸进行测定,发现其浓度小于1mol/L,引起误差的原因可能是 。
| A.定容时俯视容量瓶刻度线 |
| B.容量瓶在使用前未干燥,里面有少量蒸馏水 |
| C.转移溶液后,未洗涤烧杯和玻璃棒 |
| D.定容摇匀后发现液面低于容量瓶的刻度线,再加水至刻度线 |
(1)他利用买来的鸡蛋的蛋清配制成溶液,用激光笔照射溶液,发现一条光束穿过鸡蛋清溶液,此现象称为____________________。
(2)他将乙同学配制好的盐酸溶液加入到鸡蛋清溶液中,发现出现絮状沉淀,此现象称为_________。
IV. 丁同学试图测定CO2的相对分子质量。
①利用丙同学用完后剩下的鸡蛋壳和乙同学配制好的稀盐酸溶液制备CO2;
②查询相关书籍后,设计了如下装置:
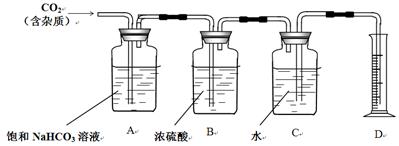
(1)B装置在此处____必要(填写“有”、“无”)请简述原因_________________________________。
(2)A装置中的饱和NaHCO3溶液可以吸收______________。
(3)实验前测得C装置(含水)重量为50.00g,实验完毕后C装置(含水)重量为40.02g,D中量筒读数为10.0 mL,已知H2密度为0.09g/L(以上数据均已折合为标况下数值),请根据以上数据,计算CO2的相对分子质量为____________(保留小数点后一位)。
草酸是一种重要的试剂。下面是利用草酸探究浓度对反应速率影响的实验。
(1)为证明浓度对反应速率的影响,曾有教科书《化学反应原理》设计了如下实验:取两支试管,各加入4mL0.01mol·L-1的KMnO4酸性溶液,分别向其中加入0.1 mol·L-1、0.2 mol·L-1 H2C2O4溶液2mL,记录溶液褪色所需时间。
实验中发生反应的离子方程式为: ;
预期现象是:
①溶液的颜色由 色变为 色,
②其中加入 mol·L-1H2C2O4的那支试管中的溶液先变色。
然而实验结果并不尽如人意。实验过程颜色复杂,且褪色先缓慢,后逐渐加快;最大的问题是草酸浓度大,反应速率却更慢。
本实验能否作为课堂实验研究浓度对化学反应速率的影响?适宜的条件是怎样的?某校一研究小组对此进行了探究。下面是他们的实验报告的一部分:
表1 试验安排及结果
| 实验 编号 | A(KMnO4溶液浓度/mol·L-1) | B(草酸溶液浓度/mol·L-1) | C(硫酸溶液浓度/mol·L-1) | 褪色时间/s |
| 1 | 3 | 3 | 1 | 336 |
| 2 | 1 | 2 | 3 | 82 |
| 3 | 3 | 1 | 3 | 76 |
| 4 | 1 | 3 | 2 | 133 |
| 5 | 2 | 3 | 3 | 102 |
| 6 | 3 | 2 | 2 | 156 |
| 7 | 2 | 2 | 1 | 300 |
| 8 | 2 | 1 | 2 | 115 |
| 9 | 1 | 1 | 1 | 200 |
应用SPSS16.0对正交试验结果进行方差分析,结果如下表
表2 各因素水平的数据处理结果
| | A(KMnO4溶液) | B(草酸溶液) | C(硫酸溶液) | ||||||
| 浓度/mol·L-1 | 0.005 | 0.010 | 0.015 | 0.1 | 0.5 | 0.9 | 6 | 12 | 18 |
| 平均褪色时间/s | 138.3 | 172.3 | 189.3 | 130.3 | 179.3 | 190.3 | 278.7 | 134.7 | 86.7 |
(2)由表2可知,三因素中, 的浓度(选填“A、B或C”,下空同)对反应速率影响显著,而 的浓度对反应速率的影响不显著。
(3)由表2可知,当高锰酸钾浓度为 mol·L-1、草酸浓度为 mol·L-1时,反应最快。即因素A、B的较适宜实验条件得以确定。
根据以上实验结果,该小组同学继续探究硫酸的浓度是怎样影响本反应速率的,测得如下实验结果:
表3 不同硫酸浓度下的褪色时间
| c(H2SO4)/mol·L-1 | 18 | 16 | 14 | 12 | 10 | 8 | 6 |
| 褪色时间/s | 67 | 83 | 90 | 103 | 129 | 146 | 200 |
(4)根据课堂实验的合适时间,可选溶液的褪色时间约为1分钟和2分钟的两份溶液,即此时硫酸的浓度为 mol·L-1和 mol·L-1,这也有利于观察这两个反应速率的差异。
结论:草酸与酸性高锰酸钾溶液的反应,可作为课堂实验探究浓度对反应速率的影响。
(10分)某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体________g。
(2)从下图中选择称量NaOH固体所需要的仪器(填字母):__________。
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |  |  |  |  |  |
| 序号 | a | b | c | d | e | f |
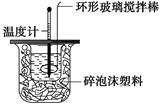
(1)写出该反应的热化学方程式(中和热为57.3 kJ·mol-1):_________________________
________________________________________________________________________。
(2)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白:
 温度 温度实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
③上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母)____________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度