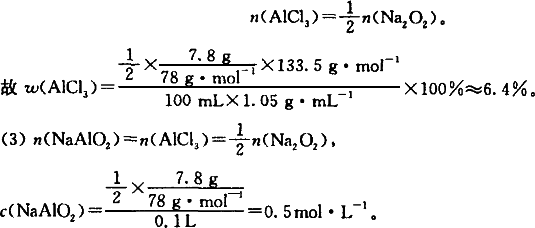题目内容
将7.8 g Na2O2粉末加入到100 mL AlCl3溶液(密度为1.05 g·mL-1)中,开始产生沉淀,后又恰好溶解(假定反应前后溶液体积不变).
(1)写出有关反应的化学方程式:
①________;
②________;
③________.
(2)原AlCl3溶液的质量分数为:________.
(3)最后所得溶液中含铝的化合物的物质的量浓度为:________.
答案:
解析:
解析:
|
(1)①2Na2O2+2H2O=4NaOH+O2↑;②AlCl3+3NaOH=Al(OH)3↓+3NaCl;③Al(OH)3+NaOH=NaAlO2+2H2O. (2)依多步反应的关系式知沉淀恰好溶解时,有:2Na2O2~AlCl3,即:
|

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
|
现有下列物质 ①2.3 g Na ②6.2 g Na2O ③7.8 g Na2O2 ④4.0 g NaOH,把它们分别放入100 g水中,对所得的溶液的质量分数中正确的是 | |
| [ ] | |
A. |
③>②>①>④ |
B. |
③=②>①>④ |
C. |
④>③>②>① |
D. |
③=②>④=① |
|
设NA表阿伏加德罗常数,N代表粒子数目.下列叙述正确的是 | |
| [ ] | |
A. |
标准状况下2.24 L H2O中,分子数为0.1NA |
B. |
将1 mol Cl2通入到水中,N(HClO)+N(Cl-)+n(ClO-)=2NA |
C. |
常温常压下16 g O2和O3混合气体中.氧原子数为NA |
D. |
7.8 g Na2O2与足量水反应,转移电子数为0.2NA |