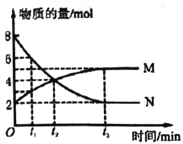
题目内容
【题目】在如图所示的装置中,若通直流电5min时,铜电极质量增加2.16g。请回答下列问题:

(1)电源中Y电极为直流电源的__________极。
(2)pH变化:A:________B:________ C:_________(填“增大”、“减小”或“不变”)。
(3)若A中KCl溶液的体积是200 mL,电解后,溶液的pH为__________(设电解前后溶液体积无变化)。
【答案】 正极 A增大 B减小 C不变 13
【解析】铜电极质量增加2.16g,说明铜电极是阴极,据此判断电源的正负极和电池中的阴阳极。根据离子的放电顺序结合电子得失守恒分析解答。
(1)通直流电5min时,铜电极质量增加2.16g,说明铜电极是阴极,银离子放电,银电极是阳极,所以Y是电源的正极;(2)惰性电极电解氯化钾溶液生成氢氧化钾,pH增大;惰性电极电解硫酸铜和硫酸钾的混合溶液有硫酸生成,pH减小;C是电镀池,pH不变;(3)2.16g银的物质的量是2.16g÷108g/mol=0.02mol,转移0.02mol电子。则根据电子得失守恒可知A中产生0.02molKOH,若A中KCl溶液的体积是200 mL,电解后氢氧化钾浓度是0.02mol÷0.2L=0.1mol/L,所以溶液的pH为13。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目