题目内容
(10分)室温下取0.2 mol·L-1HCl溶液与0.2 mol·L-1 MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,试回答以下问题:
(1)①混合溶液中水电离出的c(H+)__________0.2mol·L-1 HCl溶液中水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)=__________ mol·L-1 c(H+)-c(MOH) =__________ mol·L -1
-1
(2)室温下如果取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度________MCl的水解程度。(填“>”、“<”、或“=”),溶液中各离子浓度由大到小的顺序为_______________________。
(1)①混合溶液中水电离出的c(H+)__________0.2mol·L-1 HCl溶液中水电离出的c(H+);(填“>”、“<”、或“=”)
②求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Cl-)-c(M+)=__________ mol·L-1 c(H+)-c(MOH) =__________ mol·L
 -1
-1(2)室温下如果取0.2 mol·L-1 MOH溶液与0.1 mol·L-1 HCl溶液等体积混合,测得混合溶液的pH<7,则说明MOH的电离程度________MCl的水解程度。(填“>”、“<”、或“=”),溶液中各离子浓度由大到小的顺序为_______________________。
略

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案
相关题目
 离出的H+浓度由大到小的顺序是 (填序号)。
离出的H+浓度由大到小的顺序是 (填序号)。 。
。
 (偏高、偏低或无影响)。
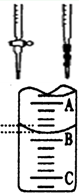
(偏高、偏低或无影响)。 管中的液面,右图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL。
管中的液面,右图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL。
 2)若所得混合溶液为中性,且a+b=12,则Va∶Vb=___ 。
2)若所得混合溶液为中性,且a+b=12,则Va∶Vb=___ 。 液中,以0.50 mol/L氢氧化钠溶液滴定后得滴定曲线如图所示。
液中,以0.50 mol/L氢氧化钠溶液滴定后得滴定曲线如图所示。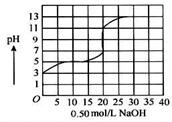
 的浓度是0.15 mol/L
的浓度是0.15 mol/L