题目内容
下列热化学方程式书写正确的是(ΔH的绝对值均正确) ( )
| A.C(s)+1/2O2(g)=CO(g) ΔH=-110.5kJ·mol-1 (燃烧热) |
| B.2H2O(g)=2H2(g)+O2(g) ΔH=+483.6 kJ·mol-1(反应热) |
| C.C2H5OH+3O2=2CO2+3H2O ΔH=-1368.8 kJ·mol-1(反应热) |
| D.2NaOH(aq)+H2SO4(aq)=Na2SO4 (aq)+2H2O(l) ΔH=-114.6 kJ·mol-1(中和热) |
B
试题分析:A. 燃烧热是1摩尔的物质完全燃烧产生稳定的氧化物时所放出的热量。C完全燃烧产生的稳定的氧化物是CO2,不是CO。错误。B.氢气燃烧放热,则水分解吸热,二者能量数值相等,符号相反。正确。C.物质所含有的能量的多少与聚集状态有关。没指明聚集状态,则能量的大小无意义。错误。D.中和热是酸碱发生中和反应产生1摩尔的水时放出的热量。与发生反应的酸碱的物质的量的多少无关。错误。

练习册系列答案
相关题目
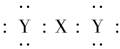
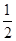 O2(g)=CO2(g)+2H2(g)
O2(g)=CO2(g)+2H2(g)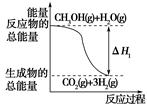
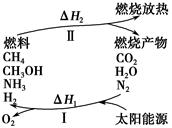
 2CO+O2 ②2H2O===2H2+O2 ③2N2+6H2O
2CO+O2 ②2H2O===2H2+O2 ③2N2+6H2O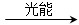 ________+3O2
________+3O2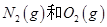 反应生成
反应生成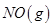 过程中的能量变化,下列说法正确的是
过程中的能量变化,下列说法正确的是
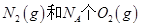 反应放出的能量为180kJ
反应放出的能量为180kJ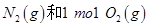 具有的总能量小于2mol
具有的总能量小于2mol 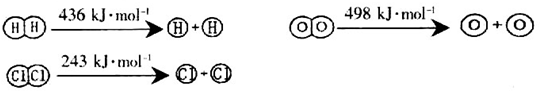
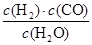 ,它所对应的化学方程式为________________。
,它所对应的化学方程式为________________。 2NH3(g) △H<0在400℃时K=0.5,此条件下在0.5L的密闭容器中进行该反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应υ(N2)正______υ(N2)逆(填“>”、“<”或“=”)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的措施是_______(填序号)。
2NH3(g) △H<0在400℃时K=0.5,此条件下在0.5L的密闭容器中进行该反应,一段时间后,测得N2、H2、NH3的物质的量分别为2mol、1mol、2mol,则此时反应υ(N2)正______υ(N2)逆(填“>”、“<”或“=”)。欲使得该反应的化学反应速率加快,同时使平衡时NH3的体积百分数增加,可采取的措施是_______(填序号)。