题目内容
10.美国等国家发射的航天器将华裔科学家丁肇中负责研制的磁谱仪带人太空,其目的是探索反物质.反物质的主要特征是电子带正电荷,质子带负电荷.以下表示反物质酸碱中和反应的通式是( )| A. | H-+OH+=H2O | B. | H++OH+=H2O | C. | H-+OH-=H2O | D. | H++OH-=H2O |
分析 主要是结合题目所给的信息进行分析,中和反应的实质是氢离子与氢氧根离子的结合,然后结合反物质”的主要特征是电子带正电荷,质子带负电荷判断即可.
解答 解:中和反应的通式是氢离子与氢氧根离子结合成水,所以结合氢离子实际上是质子,反物质带负电,氢氧根离子多余一个电子带正电,从而可判断A正确.
故选A.
点评 此题是一道信息给予题,解题的关键是抽取题干中的有效信息““反物质”的主要特征是电子带正电荷,质子带负电荷”.

练习册系列答案
相关题目
20.铜可以用来制作导线,铜的下列性质与此无关的是( )
| A. | 铜有优良的导电性 | B. | 铜在干燥的空气中不易被氧化变质 | ||
| C. | 铜较易冶炼,属常见金属 | D. | 铜的密度比较大 |
1.如图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol•L-1,工作一段时间后,测得两端导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是( )

| A. | 产生气体的体积:①>② | |
| B. | 两极上析出物质的质量:①>② | |
| C. | 溶液的pH变化:①增大,②减小 | |
| D. | 电极反应式:①中阳极:4OH--→2H2O+O2↑+4e-;②中阴极:2H++2e--→H2↑ |
18.在[Fe(CN)6]3-配离子中,中心离子的配位数为( )
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
5.有Xn+、Ym+、Zn-,已知它们各自带有的电荷数值m>n,且X、Y、Z三种原子的M电子层中的电子数均为奇数.若按X→Y→Z的顺序,下列说法中正确的是( )
| A. | 它们的最高价氧化物的相应水化物的碱性依次减弱,酸性依次增强 | |
| B. | 它们的原子半径依次增大 | |
| C. | 它们的单质在常温.常压下的密度依次减小 | |
| D. | 它们的最高价氧化物的水化物都是强电解质 |
15.下列原子的价电子排布正确的是( )
| A. |  | B. |  | C. |  | D. |  |
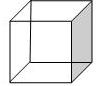 “立方烷”是一祌新合成的烃,其分子为正立方体结构,其碳架结构如图所示
“立方烷”是一祌新合成的烃,其分子为正立方体结构,其碳架结构如图所示 .
.