题目内容
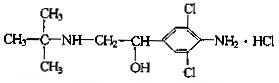
在含有NaI、Na2SO3和FeBr2各1 mol的溶液中通入足量的Cl2,将溶液在空气中加热蒸干并充分灼烧,最终得到剩余的固体物质是
- A.NaCl、FeCl3、Na2SO4
- B.NaCl、FeBr3
- C.NaCl、Fe2O3、Na2SO4
- D.硫酸锰
C
本题综合考查氧化还原反应与元素化合价、盐类水解等知识点。由还原性强弱知:Cl-<Br-<Fe2+<I-<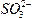 ,强氧化剂Cl2与粒子
,强氧化剂Cl2与粒子![]() 、I-、Fe2+、B-分别依次反应,由于Cl2足量,依次发生反应为Na2SO3+Cl2+H2O====Na2SO4+2HCl、2NaI+Cl2====2NaCl+I2、2FeBr2+3Cl2====2FeCl3+2Br2。当溶液在空气中加热蒸干并充分灼烧时,FeCl3发生水解生成Fe(OH)3,灼烧得产物Fe2O3,而产物Br2、I2、HCl和过量的Cl2加热挥发,所以最终得到剩余的固体物质为NaCl、Fe2O3、Na2SO4。
、I-、Fe2+、B-分别依次反应,由于Cl2足量,依次发生反应为Na2SO3+Cl2+H2O====Na2SO4+2HCl、2NaI+Cl2====2NaCl+I2、2FeBr2+3Cl2====2FeCl3+2Br2。当溶液在空气中加热蒸干并充分灼烧时,FeCl3发生水解生成Fe(OH)3,灼烧得产物Fe2O3,而产物Br2、I2、HCl和过量的Cl2加热挥发,所以最终得到剩余的固体物质为NaCl、Fe2O3、Na2SO4。
本题综合考查氧化还原反应与元素化合价、盐类水解等知识点。由还原性强弱知:Cl-<Br-<Fe2+<I-<
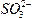 ,强氧化剂Cl2与粒子
,强氧化剂Cl2与粒子
练习册系列答案
相关题目