题目内容
某兴趣小组的学生根据Mg与CO2反应原理,推测钠也应能在CO2中燃烧。为了确定其生成产物并进行实验论证,请你参与以下研究过程。
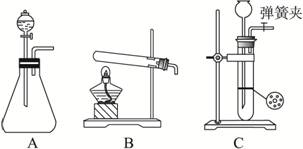
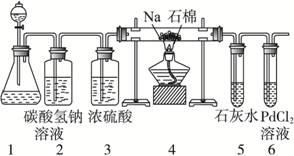
(1)甲同学首先设计了实验室制取二氧化碳的三种发生装置,若选用碳酸氢钠分解制二氧化碳应选用装置是_______(填装置序号“A”“B”或“C”,下同);若用石灰石与稀盐酸为原料,并能控制反应随时发生随时停止,最好应选用的装置是_______;若用碳酸钠固体与稀硫酸反应应选用的装置是_______。
(2)乙同学按实验要求,用下列装置进行实验(已知PdCl2溶液能被CO还原得到黑色的Pd),请完成下列问题:
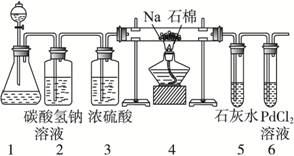
①若装置6中有黑色沉淀,装置4中的残留固体(只有一种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:_____________________。
②若装置6中溶液无明显现象,装置4中残留固体(有两种物质)加盐酸有能使石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式为:_____________________。
(3)指导老师认为,不仅要检验残留固体中是否有碳酸钠还要检验其中是否有氧化钠和碳,当确认钠充分反应后,请你设计一个简单实验,验证装置4中得到的残留固体中是否含有Na2O和C。
(1)BCA
(2)①2Na+2CO2![]() CO+Na2CO3②4Na+3CO2
CO+Na2CO3②4Na+3CO2![]() 2Na2CO3+C
2Na2CO3+C
(3)将残留物溶于适量水,若有黑色不溶物则证明残留物中有C,在溶液中加足量BaCl2溶液,然后过滤,在滤液中滴加几滴酚酞,若溶液变红,则证明残留物中含有Na2O。
解析:
(2)①装置6中有黑色沉淀,依题中信息知产生了CO,残留物与HCl作用产生CO2,则残留物中含Na2CO3。
②残留物与HCl作用产生CO2,证明残留物中含Na2CO3,而又无CO产生,根据氧化还原反应规律知,钠被氧化,则必有元素被还原,联系残留固体中有两种物质故知有C生成。
(3)根据碳不溶于水,可证明之,根据Na2O+H2O![]() 2NaOH溶液显碱性可证明Na2O存在,但Na2CO3溶液也显碱性,对实验有干扰,故先将
2NaOH溶液显碱性可证明Na2O存在,但Na2CO3溶液也显碱性,对实验有干扰,故先将![]() 用Ba2+沉淀。
用Ba2+沉淀。

 名校课堂系列答案
名校课堂系列答案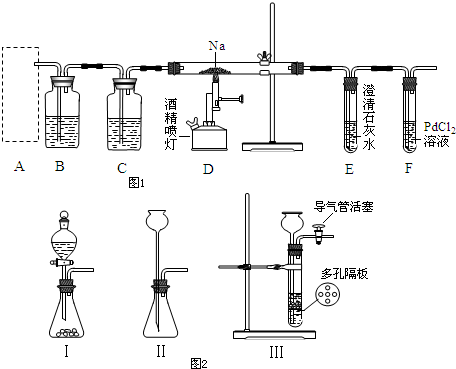
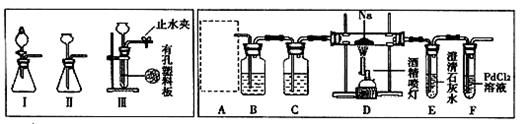

 (4)请判断②中D装置生成固体的成分是钠的正盐还是酸式盐?请用文字简要说明理由。
(4)请判断②中D装置生成固体的成分是钠的正盐还是酸式盐?请用文字简要说明理由。