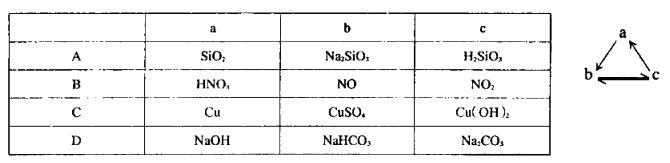
题目内容
根据下列有关实验得出的结论一定正确的是
| 选项 | 方法 | 结论 |
| A | 同温时,等质量的锌粒分别与足量稀硫酸反应 | 产生氢气量:加过胆矾=没加胆矾 |
| B | 向Fe(NO3)2溶液中滴入用硫酸酸化的H2O2溶液,则溶液变黄 | 氧化性:H2O2>Fe3+ |
| C | 相同温度下,等质量的大理石与等体积、等浓度的盐酸反应 | 反应速率:粉状大理石>块状大理石 |
| D | 向2mL 0.1mol·L-1Na2S溶液中滴入几滴0.1mol·L-1ZnSO4溶液,有白色沉淀生成;再加入几滴0.1mol·L-1 CuSO4溶液,则又有黑色沉淀生成 | 溶度积(Ksp):ZnS>CuS |
C
试题分析:A、锌与硫酸铜生成铜,形成原电池,加胆矾的比未加胆矾的反应速率快,但加胆矾的比未加胆矾的产生氢气体积小,错误;B、酸性条件下,NO3-具有强氧化性,能将Fe2+氧化为Fe3+,错误;C、粉状比块状与盐酸接触面积大,反应速率快,正确;D、硫化钠与硫酸锌反应时,硫化钠过量,再加硫酸铜生成硫化铜沉淀,不是发生沉淀的转化,错误。

练习册系列答案
相关题目
 y
y