题目内容
a mol乙炔跟b mol氢气在密闭容器中反应,当其达到平衡时,生成c mol乙烯,将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量是( )
分析:据元素守恒,反应后混合气体的耗氧量即是amolC2H2和bmolH2的耗氧量,反应生成CO2和H2O,根据碳元素守恒有n(CO2)=2n(C2H2),根据氢元素守恒由n(H2O)=n(C2H2)+n(H2),根据氧元素守恒有2n(O2)=2n(CO2)+n(H2O),据此计算消耗的氧气.
解答:解:反应前后C和H反应后元素的质量没有发生变化,则混合气体的耗氧量即是amolC2H4和bmolH2的耗氧量,
根据碳元素守恒有n(CO2)=2n(C2H2)=2amol,
根据氢元素守恒由n(H2O)=n(C2H2)+n(H2)=amol+bmol,
根据氧元素守恒有2n(O2)=2n(CO2)+n(H2O)=2×2amol+amol+bmol=5amol+bmol,
即n(O2)=
(5a+b)mol.
故选D.
根据碳元素守恒有n(CO2)=2n(C2H2)=2amol,
根据氢元素守恒由n(H2O)=n(C2H2)+n(H2)=amol+bmol,
根据氧元素守恒有2n(O2)=2n(CO2)+n(H2O)=2×2amol+amol+bmol=5amol+bmol,
即n(O2)=
| 1 |
| 2 |
故选D.
点评:本题考查混合物的计算,难度中等,判断反应后混合气体的耗氧量即是amolC2H2和bmolH2的耗氧量是关键,在利用元素守恒计算,注意混合计算中守恒思想的运用.

练习册系列答案
 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案
相关题目
a mol乙炔跟b mol氢气在密闭容器中反应,当其达到平衡时,生成c mol乙烯,将平衡混合气体完全燃烧生成CO2和H2O,所需氧气的物质的量是
A. mol mol | B. mol mol |
C. mol mol | D. mol mol |
 mol B.
mol B. mol
mol mol D.
mol D.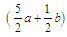 mol
mol mol
B.
mol
B.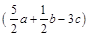 mol
mol mol
D.
mol
D.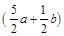 mol
mol mol
mol (5a+b)mol
(5a+b)mol