题目内容
已知理想气体各参数p(压强)、V(体积)、T(温度)、n(物质的量)满足理想气体状态方程pV=nRT。某学校课外活动小组粗略测定理想气体状态方程中气体常数R的值,下面是测定实验的分析报告,请填写有关空白:
(一)测定原理:在理想气体状态方程pV=nRT中,气体常数R=pV/nT的数值可以通过实验来确定。本实验通过金属镁置换出盐酸中的氢来测定R的值。其反应为:
Mg+2HCl=MgCl2+H2↑
如果称取一定质量的镁与过量的盐酸反应,则在一定温度和压力下,可以通过测出反应放出氢气的体积。实验室的温度和压力可以分别由温度计和气压计测得。氢气物质的量可以通过反应中镁的质量来求得。将以上所得各项数据代入R= pV /nT式中,即可算出R值。
 (二)实验用品及试剂:①仪器:托盘天平、测定气体常数的装置(如上图所示);②试剂:6mol·L-1HCl、镁条若干。
(二)实验用品及试剂:①仪器:托盘天平、测定气体常数的装置(如上图所示);②试剂:6mol·L-1HCl、镁条若干。
(三)实验内容:
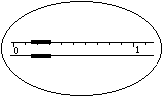
1.在托盘天平上称出镁条的质量(称量镁条天平的游码示数如右图所示,未用砝码,单位为g);
2.按上图搭好仪器。取下试管,移动量气管B,使量气管A中的水面略低于零刻度线,然后将量气管B固定。
3.在试管中加入15mL 6 mol·L-1HCl,不要使盐酸沾湿试管的上半部。将已称重的镁沾少许水,贴在试管上部不与盐酸接触。
4.检查仪器是否漏气,方法如下:(方法要求简单有效)
。
 5.如果装置不漏气,调整量气管B的位置,使量气管A内水面与量气管B 内水面在同一水平面上(要求“在同一水平面上”的原因是 ;实现“在同一水平面上”的操作是 ),然后准确读出量气管A内水面凹面最低点的读数V1(如右图所示)。
5.如果装置不漏气,调整量气管B的位置,使量气管A内水面与量气管B 内水面在同一水平面上(要求“在同一水平面上”的原因是 ;实现“在同一水平面上”的操作是 ),然后准确读出量气管A内水面凹面最低点的读数V1(如右图所示)。
6.轻轻摇动试管,使镁条落入盐酸中,镁条与盐酸反应放出氢气。此时量气管A内水面即开始下降。为了不使量气管A内气压增大而造成漏气,在量气管A内水面下降的同时,慢慢 (上或下)移量气管B,使两管内的水面基本保持水平。反应停止后,待试管冷却至室温(约10分钟),移动量气管B,使两管内的水面相平,读出反应后量气管A内的精确读数V2(如右图所示)。
7.记录实验时的室温t和大气压P。(已知室温为27℃,大气压为100kPa)
(四)数据记录与处理(在横线上填写适当内容):
| 镁条的质量 | w= |
| g |
| 氢气的物质的量 | n= |
| mol |
| 反应前量气管A内读数 | V1= |
| ml |
| 反应后量气管A内读数 | V2= |
| ml |
| 氢气的体积 | V |
| ml |
| 室温 | T |
| K |
| 大气压 | P |
| Pa |
气体常数R的值(计算过程和结果):
(五)问题与讨论:①在读取量气管内气体体积V1时,眼睛仰视读数,结果造成R的测定值 (偏高、偏低或无影响);②若没等反应试管冷却到室温就量取液面的高度,结果造成R的测定值 (偏高、偏低或无影响)。
(三)4.提升B管,使B管内液面高于A管,通过观察A管内液面是否下降可知是否漏气,若A管内液面不下降,则说明气密性好;若A管内液面下降,则说明装置漏气。
5.使A、B两管中液面在同一水平面上的原因是使内外气体压强相等(均为大气压);调节的方法是上下移动B管即可。
6.下
(四)
| 镁条的质量 | w= | 0.15 | g |
| 氢气的物质的量 | n= | 0.00625 | mol |
| 反应前量气管A内读数 | V1= | 2.8 | ml |
| 反应后量气管A内读数 | V2= | 158.8 | ml |
| 氢气的体积 | V | 156 | ml |
| 室温 | T | 300 | K |
| 大气压 | P | 1×105 | Pa |
气体常数R值的计算过程:
![]()
(五)①偏小 ②偏大
解析:
本试题的目的是用实验测定物理学中的理想气体状态方程中气体常数R的数值,实验通过金属镁与盐酸反应置换出氢气来测定R的值,显然是一道理化实验综合题。题目要求学生将物理知识和化学实验设计的思想有机结合,利用物理学中的压强知识来准确读取量气管的读数值,并根据实验要求进行有关的操作和数据的处理,试题的综合度较强,对学生的能力要求较高。必须先弄清实验原理:称取一定质量的镁与过量的盐酸反应,测出反应放出氢气的体积V。实验室的温度T和压力P可以分别由温度计和气压计测得。氢气物质的量n可以通过反应中镁的质量来求得。将以上所得各项数据代入R= pV /nT式中,即可算出R值。检查仪器是否漏气的简单有效的方法:可以通过提升B管,使B管内水柱有一定的压强,通过观察液面是否下降可知是否漏气。读取量气管中液面最低点的数值时,必须使A、B两管中液面在同一水平面上,只有这样,才能是内外气体压强相等(均为大气压)。调节的方法是上下移动B管即可。另外在读数时,还必须将滴定管的读数方法迁移至本题中的量气管。0刻度在最上方,应从上至下读数。在读取量气管内气体体积V1时,眼睛仰视读数,造成V1值偏大,在其它操作无误的情况下,氢气的体积V2—V1的值偏小,根据R= pV /nT可知,R的测定值偏低;若没等反应试管冷却到室温就量取液面的高度,造成V2值偏大,氢气的体积V2—V1的值偏大,R的测定值偏高。

 阅读快车系列答案
阅读快车系列答案