题目内容
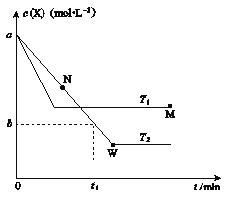
【题目】(I)、室温下,将1.000mol/L盐酸滴入20.00mL 1.000 mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。

(1)a点由水电离出的c(H+)=__________。
(2)d点溶液温度最高的原因是__________ 。
(II)电离常数是衡量弱电解质电离程度强弱的物理量。已知:化学式电离常数(25℃)HCN K=4.9×10-10,CH3COOH K=1.8×10-5,H2CO3 K1=4.3×10-7、K2=5.6×10-11,一氯乙酸K=1.4×10—3
(3)25℃时,有等浓度的:①NaCN溶液,②Na2CO3溶液,③CH3COONa溶液,三溶液的pH由大到小的顺序为________________________。(填序号)
(4)向NaCN溶液中通入少量的CO2,发生反应的化学方程式为_________________。
(5)下图中可以描述乙酸(甲曲线)和一氯乙酸(乙曲线)在水中的电离度与浓度关系的是( )
A.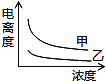 B.
B. C.
C. D.
D.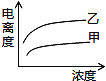
【答案】
(1)1.0×10-12mol·L-1 ;
(2)d点时盐酸和氨水恰好完全反应,放热最多;
(3)②>①>③ ;
(4)NaCN+H2O+CO2==HCN+NaHCO3;
(5)B
【解析】
试题分析:(1)因a点pH=12,则c(H+)=1.0×10-12molL-1,氨水为弱碱溶液,溶液中氢离子即为水电离出的氢离子,故答案为:1.0×10-12molL-1;
(2)d点时盐酸和氨水恰好完全反应,放热最多,因此d点溶液温度最高,故答案为:d点时盐酸和氨水恰好完全反应,放热最多;
(3)根据图表数据分析,电离常数:醋酸>HCN>碳酸氢根离子,所以等浓度的NaCN溶液、Na2CO3溶液、CH3COONa溶液水解程度为:Na2CO3溶液>NaCN溶液>CH3COONa溶液,故溶液的pH为:Na2CO3溶液>NaCN溶液>CH3COONa溶液;故答案为:②>①>③;
(4)向NaCN溶液中通入少量CO2,由于酸性:H2CO3>HCN>HCO3-,故反应生成HCN和碳酸氢钠,不能生成二氧化碳,故反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3,故答案为:NaCN+H2O+CO2=HCN+NaHCO3;
(5)由乙酸(甲、Ka=1.8×10-5)和一氯乙酸(乙、Ka=1.4×10-3)可知,乙酸的Ka小,则乙酸的酸性弱;由图可知,横坐标为浓度,纵坐标为电离度,则等浓度时酸性强的电离度大,即乙的曲线在上方,可排除A、C;弱酸的浓度越大,其电离度越小,则曲线甲、乙均随浓度的增大而下降,可排除D,显然只有B符合,故选B。

 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案