题目内容
人的血液里Ca2+的浓度一般采用g·cm-3表示,今抽一血样20.00 mL加入适量的草酸铵[(NH4)2C2O4]溶液,可析出CaC2O4沉淀,将沉淀冼净后溶于强酸可得草酸,再用浓度为0.02 mol·L-1的KMnO4溶液滴定。当观察到溶液紫色褪尽时,共消耗12.00 mL KMnO4溶液。则该血液样品中Ca2+的浓度为( )
- A.0.0015 g·cm-3
- B.0.0012 g·cm-3
- C.0.0024 g·cm-3
- D.0.002 g·cm-3
B
试题分析:根据关系式5Ca2+~5CaC2O4~5H2C2O4~2MnO4-可计算出n(Ca2+):
n(Ca2+)=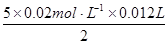 =6×10-4 mol
=6×10-4 mol
20 mL血液中Ca2+的浓度为:
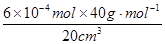 =1.2×10-3 g·cm-3。
=1.2×10-3 g·cm-3。
考点:考查滴定实验的有关计算
点评:该题以测定人体血液中Ca2+的浓度为载体,重点考查学生对利用关系式进行计算的熟悉了解程度,意在培养学生的逻辑推理能力和分析、归纳、总结问题的能力,提高学生的应试能力和答题效率。
试题分析:根据关系式5Ca2+~5CaC2O4~5H2C2O4~2MnO4-可计算出n(Ca2+):
n(Ca2+)=
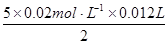 =6×10-4 mol
=6×10-4 mol20 mL血液中Ca2+的浓度为:
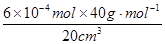 =1.2×10-3 g·cm-3。
=1.2×10-3 g·cm-3。考点:考查滴定实验的有关计算
点评:该题以测定人体血液中Ca2+的浓度为载体,重点考查学生对利用关系式进行计算的熟悉了解程度,意在培养学生的逻辑推理能力和分析、归纳、总结问题的能力,提高学生的应试能力和答题效率。

练习册系列答案
相关题目
人的血液里Ca2+的浓度一般采用g·cm-3表示,今抽一血样20.00 mL加入适量的草酸铵[(NH4)2C2O4]溶液,可析出CaC2O4沉淀,将沉淀冼净后溶于强酸可得草酸,再用浓度为0.02 mol·L-1的KMnO4溶液滴定。当观察到溶液紫色褪尽时,共消耗12.00 mL KMnO4溶液。则该血液样品中Ca2+的浓度为( )
| A.0.0015 g·cm-3 | B.0.0012 g·cm-3 |
| C.0.0024 g·cm-3 | D.0.002 g·cm-3 |