题目内容
【题目】在 K2Cr2O7+14HCl═2KCl+2CrCl3+3Cl2+7H2O反应中.
(1)元素被氧化,是氧化剂.
(2)是氧化产物,发生氧化反应.
(3)在参加反应的盐酸中,起还原剂(被氧化)作用的HCl与起酸性作用的HCl的质量比为 .
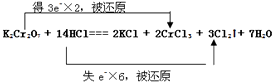
(4)用线桥法标明电子转移的方向和数目. .
【答案】
(1)氯,K2Cr2O7
(2)Cl2,HCl
(3)3:4
(4)
【解析】解:(1)化合价升高的元素是氯元素,被氧化,K2Cr2O7中铬元素的化合价降低,为氧化剂;
(2)化合价升高的氯元素所在的生成物氯气是氧化产物,HCl做还原剂被氧化,发生氧化反应;
(3)起还原剂(被氧化)作用的HCl为6mol,起酸性作用的HCl为8mol,物质的量之比=质量比=3:4;
(4)氧化还原反应的电子转移情况是:  ;
;
故答案为:(1)氯;K2Cr2O7;(2)Cl2、HCl;(3)3:4;(4)
(1)反应过程中,元素化合价升高,则被氧化;有元素化合价降低的物质,为氧化剂。
(2)在反应中,有元素化合价升高的物质,发生氧化反应,所得产物为氧化产物。
(3)在该反应中,被氧化的Cl有6mol,起酸性作用的有8mol。
(4)用双线桥表示电子转移时,应注意箭头指向的为同一种元素,转移电子数可从化合价变化确定。

练习册系列答案
 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案
相关题目