题目内容
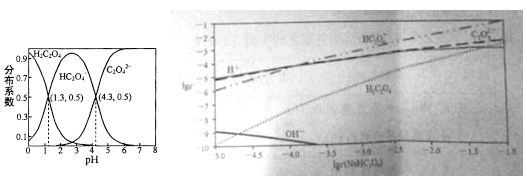
【题目】室温下,向H2C2O4溶液中逐滴加入NaOH溶液,所得溶液中H2C2O4,HC2O4-,C2O42-三者物质的量分数(分布系数)随pH变化的关系入左图所示。右图为不同浓度NaHC2O4溶液中部分微粒浓度。下列表述错误的是
A. HC2O4-![]() H++C2O42- K=1×10-4.3
H++C2O42- K=1×10-4.3
B. 将等物质的量的NaHC2O4、Na2C2O4溶于水中,所得溶液pH恰好为4.3
C. NaHC2O4溶液中一定存在c(C2O42-)>c(H2C2O4),同时c(H+)>c(OH-)
D. 在0.1mol/L NaHC2O4溶液中各离子浓度大小关系为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)> c(H+)>c(OH-)
【答案】B
【解析】A.K= =1×10-4.3,故A正确;B.c(C2O42-)=c(HC2O4-)的溶液pH=4.3即呈酸性,说明HC2O4-的电离程度大于C2O42-的水解程度,所以起始浓度c(C2O42-)<c(HC2O4-),故B错误;C.在含有HC2O4-的溶液中pH<7即c(H+)>c(OH-),说明HC2O4-的电离程度大于水解程度,所以c(C2O42-)>c(H2C2O4),故C正确;D.在0.1mol/L NaHC2O4溶液中,HC2O4-的电离程度大于水解程度,而且电离程度和水解程度都很小,所以各离子浓度大小关系为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)> c(H+)>c(OH-),故D正确。故选B。
=1×10-4.3,故A正确;B.c(C2O42-)=c(HC2O4-)的溶液pH=4.3即呈酸性,说明HC2O4-的电离程度大于C2O42-的水解程度,所以起始浓度c(C2O42-)<c(HC2O4-),故B错误;C.在含有HC2O4-的溶液中pH<7即c(H+)>c(OH-),说明HC2O4-的电离程度大于水解程度,所以c(C2O42-)>c(H2C2O4),故C正确;D.在0.1mol/L NaHC2O4溶液中,HC2O4-的电离程度大于水解程度,而且电离程度和水解程度都很小,所以各离子浓度大小关系为:c(Na+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4)> c(H+)>c(OH-),故D正确。故选B。

练习册系列答案
相关题目