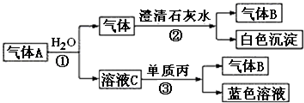
题目内容
16.某温度下,纯水中的c(H +)=5.0×10-7mol/L,则此时c(OH -)=5.0×10-7mol/L.相同条件下,测得①NaHCO3(aq) ②CH3COONa(aq)③NaClO(aq)三种稀溶液的pH值相同.它们的物质的量浓度由大到小的顺序是②>①>③.分析 纯水显中性,故溶液中的氢离子和氢氧根的浓度相同;
对应酸的酸性越弱,其盐的水解程度越大,溶液的碱性越强,溶液pH越大;当pH相同时,酸越强,盐的浓度越大.
解答 解:任何温度下,纯水均显中性,即纯水中都存在c(H+)=c(OH-)=5.0×10-7 mol•L-1;
在相同的条件下测得①NaHCO3 ②CH3COONa ③NaClO三种溶液pH相同,已知酸性:CH3COOH>HClO>HCO3-,所以水解程度:NaClO>NaHCO3>CH3COONa,pH相同时,溶液的浓度:NaClO<NaHCO3<CH3COONa,即②>①>③.
故答案为:5.0×10-7;②>①>③.
点评 本题考查了利用纯水显中性来求算水的离子积kw以及盐溶液“越弱越水解:的规律等知识点,题目难度中等,应注意酸或碱越弱,则对应的盐的水解程度越大的规律.

练习册系列答案
相关题目
7.为了使FeCl3溶液中$\frac{c(F{e}^{3+})}{c(c{l}^{-})}$增大,可加入的物质是( )
| A. | 适量的HCl气体 | B. | 适量的硫酸氢钠 | C. | 适量的NaOH固体 | D. | 适量的稀HNO3 |
4.在平衡体系2NO+O2?2NO2中通入18O组成的氧气,重新达到平衡后,则18O( )
| A. | 只存在于O2中 | B. | 只存在于NO2中 | ||
| C. | 只存在于O2和NO2中 | D. | 存在于NO、O2、NO2 |
11.下列说法中,不正确的是( )
| A. | 电解质的电离,既是化学过程,也是化学反应 | |
| B. | 即使没有发生化学变化,也可能有能量的变化 | |
| C. | 化学反应中既有物质变化又有能量变化 | |
| D. | 物质的化学能可以通过不同的变化方式转化为热能、电能等 |
8.某温度下,在定容的密闭容器中,建立了如下平衡:2NO2(g)?N2O4(g),若再向容器中通入一定量的NO2气体或N2O4气体,重新达到平衡后,容器内NO2气体质量分数比原平衡时( )
| A. | 都增大 | B. | 前者增大,后者减小 | ||
| C. | 都减小 | D. | 前者减小,后者增大 |
2.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 无色溶液中可能大量存在:Fe2+、H+、SO${\;}_{3}^{2-}$、ClO- | |
| B. | pH=1的溶液中:K+、SO42-、OH-、AlO2- | |
| C. | 酸性溶液中可能大量存在K+、Fe3+、NO3-、SO42- | |
| D. | 水溶液中:Fe2+、H+、SO${\;}_{3}^{2-}$、ClO- |
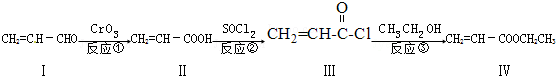
 (注明反应条件).
(注明反应条件).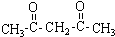 或CH2=CH-O-CH2-O-CH=CH2.
或CH2=CH-O-CH2-O-CH=CH2.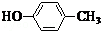 也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为
也可与化合物Ⅲ发生类似反应③的反应,则得到的产物的结构简式为 .
.