题目内容
下列不能说明氯的非金属性比硫强的事实是( )
①HCl比H2S稳定 ②HClO氧化性比H2SO4强 ③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S ⑤Cl原子最外层有7个电子,S原子最外层有6个电子 ⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS ⑦HCl酸性比H2S强.
①HCl比H2S稳定 ②HClO氧化性比H2SO4强 ③HClO4酸性比H2SO4强 ④Cl2能与H2S反应生成S ⑤Cl原子最外层有7个电子,S原子最外层有6个电子 ⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS ⑦HCl酸性比H2S强.
分析:比较非金属性的强弱,可根据①氢化物的稳定性,②最高价氧化物对应的水化物的酸性,③对应的单质的氧化性,④单质之间的置换反应⑤与氢气反应的剧烈程度等判断.
解答:解:①元素的非金属性越强,对应的氢化物越稳定,HCl比H2S稳定,可说明非金属性:Cl>S,故①正确;
②HClO氧化性比H2SO4强不能作为比较非金属性强弱的依据,故②错误;
③元素的非金属性越强,对应的最高价氧化物对应的水化物的酸性越强,HClO4酸性比H2SO4强,可说明非金属性:Cl>S,故③正确;
④Cl2能与H2S反应生成S,可说明氧化性:Cl2>S,单质的氧化性越强,对应元素的非金属性越强,故④正确;
⑤不能以最外层电子数的多少判断非金属性的强弱,例如O的最外层电子数为6,I的最外层电子数为7,但O的非金属性大于I,故⑤错误;
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS,可说明氧化性:Cl2>S,单质的氧化性越强,对应元素的非金属性越强,故⑥正确;
⑦比较非金属性的强弱,应根据对应的最高价氧化物对应的水化物的酸性比较,不能根据氢化物的酸性进行比较,例如HF的酸性比HCl弱,但非金属性F大于Cl,故⑦错误.
故选A.
②HClO氧化性比H2SO4强不能作为比较非金属性强弱的依据,故②错误;
③元素的非金属性越强,对应的最高价氧化物对应的水化物的酸性越强,HClO4酸性比H2SO4强,可说明非金属性:Cl>S,故③正确;
④Cl2能与H2S反应生成S,可说明氧化性:Cl2>S,单质的氧化性越强,对应元素的非金属性越强,故④正确;
⑤不能以最外层电子数的多少判断非金属性的强弱,例如O的最外层电子数为6,I的最外层电子数为7,但O的非金属性大于I,故⑤错误;
⑥Cl2与Fe反应生成FeCl3,S与Fe反应生成FeS,可说明氧化性:Cl2>S,单质的氧化性越强,对应元素的非金属性越强,故⑥正确;
⑦比较非金属性的强弱,应根据对应的最高价氧化物对应的水化物的酸性比较,不能根据氢化物的酸性进行比较,例如HF的酸性比HCl弱,但非金属性F大于Cl,故⑦错误.
故选A.
点评:本题考查非金属性的强弱比较,题目难度不大,注意比较非金属性的角度和方法.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
 CO2
CO2 白色沉淀,说明元素的非金属性:Cl>C>Si;⑨从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶;⑩胶体和溶液的本质区别是分散剂微粒直径的不同。
白色沉淀,说明元素的非金属性:Cl>C>Si;⑨从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶;⑩胶体和溶液的本质区别是分散剂微粒直径的不同。 CO2
CO2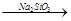 白色沉淀,说明元素的非金属性:Cl>C>Si;⑨从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶;⑩胶体和溶液的本质区别是分散剂微粒直径的不同。
白色沉淀,说明元素的非金属性:Cl>C>Si;⑨从试剂瓶中取出的任何药品,若有剩余不能再放回原试剂瓶;⑩胶体和溶液的本质区别是分散剂微粒直径的不同。 白色沉淀,说明元素的非金属性:Cl>C>Si
白色沉淀,说明元素的非金属性:Cl>C>Si