题目内容
【题目】将足量的KHCO3溶液不断滴入含等物质的量的KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀的物质的量与滴入的KHCO3溶液体积的关系可表示为
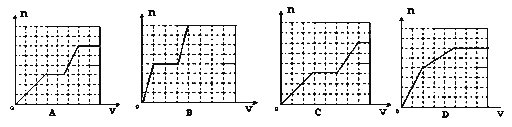
A. A B. B C. C D. D
【答案】B
【解析】试题分析:HCO3-先与OH-反应,再与AlO2-反应,而HCO3-与OH-反应生成CO32-后,Ba2+与CO32-生成沉淀,HCO3-+OH-+Ba2+═BaCO3↓+H2O①,消耗1molHCO3-、1molOH-、1molBa2+,生成1molBaCO3沉淀,此阶段化学方程式为KHCO3+Ba(OH)2═BaCO3↓+H2O+KOH;HCO3-+OH-═CO32-+H2O②,消耗2mol HCO3-、2molOH-(OH-消耗完),没有沉淀生成.此阶段化学方程式为KHCO3+KOH═K2CO3+H2O(此时KOH有2mol,原溶液中有1mol,反应①产生1mol);HCO3-+AlO2-+H2O═CO32-+Al(OH)3↓③,消耗1molHCO3-、1mol AlO2-(AlO2-消耗完),生成1molAl(OH)3沉淀.此阶段化学方程式为KHCO3+KAlO2+H2O═Al(OH)3↓+K2CO3. 三阶段消耗KHCO3的物质的量为1:2:1,也即KHCO3溶液体积比为1:2:1;一、三阶段对应的生成沉淀的物质的量为1:1,第二阶段不生成沉淀,所以图象B符合,故选B。

练习册系列答案
相关题目