题目内容
配平下列化学方程式
(1)
(2)
(1)
3
3
Cu+8
8
HNO3=3
3
Cu(NO3)2+2
2
NO↑+4
4
H2O;(2)
2
2
NaNO2+4
4
HI=2
2
NaI+2
2
NO↑+2
2
H2O+1
1
I2.分析:根据氧化还原反应中得失电子数相等进行配平.
解答:解:(1)该反应中元素的化合价变化如下:Cu→Cu(NO3)2,Cu元素的化合价由0价→+2价,一个Cu失去2个电子;
HNO3→NO,N元素的化合价由+5价→+2价,一个HNO3得到3个电子,所以得失电子的最小公倍数为6,所以Cu的计量数为3,Cu(NO3)2的计量数为3,NO的计量数为2,由于硝酸部分被还原,根据原子守恒,HNO3的计量数为8,H2O计量数为4,
故答案为:3;8;3;2;4;
(2)该反应中元素的化合价变化如下:NaNO2→NO,N元素的化合价由+3价→+2价,一个NaNO2得到1个电子;HI→I2,I元素的化合价由-1价→0价,一个HI失去1个电子,所以得失电子的最小公倍数为1,所以NaNO2的计量数为1,NaI的计量数为1,I2的计量数为
,由于HI部分被氧化,根据原子守恒,HI的计量数为2,H2O计量数为1,由于I2的计量数为
,各物质的系数同时乘以2.故答案为:2;4;2;2;2;1;
HNO3→NO,N元素的化合价由+5价→+2价,一个HNO3得到3个电子,所以得失电子的最小公倍数为6,所以Cu的计量数为3,Cu(NO3)2的计量数为3,NO的计量数为2,由于硝酸部分被还原,根据原子守恒,HNO3的计量数为8,H2O计量数为4,
故答案为:3;8;3;2;4;
(2)该反应中元素的化合价变化如下:NaNO2→NO,N元素的化合价由+3价→+2价,一个NaNO2得到1个电子;HI→I2,I元素的化合价由-1价→0价,一个HI失去1个电子,所以得失电子的最小公倍数为1,所以NaNO2的计量数为1,NaI的计量数为1,I2的计量数为
| 1 |
| 2 |
| 1 |
| 2 |
点评:本题考查了氧化还原反应方程式的配平,根据氧化还原反应中得失电子数相等配平即可,注意还原剂部分被氧化和氧化剂部分被还原.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
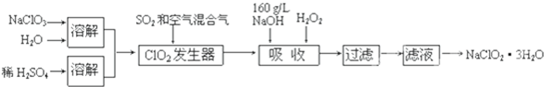

 (2011?深圳一模)氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.
(2011?深圳一模)氟和氟盐是化工原料.由于氟气性质活泼,很晚才制取出来.