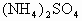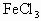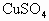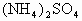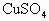题目内容
把金属钠投入下列物质的稀溶液中,溶液质量会减轻的是( )
分析:钠投入酸溶液中发生反应2Na+2H+=Na++H2↑(若酸不足,再发生反应2Na+2H2O=2NaOH+H2↑,与酸反应实质相同),将钠投入盐溶液中,首先发生反应2Na+2H2O=2NaOH+H2↑,再分析生成的氢氧化钠与盐是否发生反应,据此结合反应方程式运用差量法解答.
解答:解:溶液质量的改变应等于:加入的钠的质量减去生成氢气的质量减去生成沉淀的质量,设钠的质量都为m.
A.2Na+HC1=2NaC1+H2↑
46 2
m
溶液增重m(Na)-m(H2)=m-
=
,故A错误;
B.2Na+2H2O=2NaOH+H2↑
46 2
m
溶液增重m(Na)-m(H2)=m-
=
,故B错误;
C.2Na+2H2O=2NaOH+H2↑ 3NaOH+FeC13=3NaC1+Fe(OH)3↓
46 80 2 120 107
m
溶液增重m(Na)-m(H2)-m【Fe(OH)3】=m-
-
=-
<0,溶液质量会减轻,故C正确;
D.把金属钠投入氢氧化钠的稀溶液中,钠和水的反应方程式为:2Na+2H2O=2NaOH+H2↑,在氢氧化钠的稀溶液中无氢氧化钠析出,所以溶液质量增加,根据B可知溶液增加的质量=m(Na)-m(H2)=m-
=
,故D错误;
故选C.
A.2Na+HC1=2NaC1+H2↑
46 2
m
| 2m |
| 46 |
| 2m |
| 46 |
| 22m |
| 23 |
B.2Na+2H2O=2NaOH+H2↑
46 2
m
| 2m |
| 46 |
| 2m |
| 46 |
| 22m |
| 23 |
C.2Na+2H2O=2NaOH+H2↑ 3NaOH+FeC13=3NaC1+Fe(OH)3↓
46 80 2 120 107
m
| 80m |
| 46 |
| 2m |
| 46 |
| 80m |
| 46 |
| 107m |
| 69 |
| 2m |
| 46 |
| 107m |
| 69 |
| 41m |
| 69 |
D.把金属钠投入氢氧化钠的稀溶液中,钠和水的反应方程式为:2Na+2H2O=2NaOH+H2↑,在氢氧化钠的稀溶液中无氢氧化钠析出,所以溶液质量增加,根据B可知溶液增加的质量=m(Na)-m(H2)=m-
| 2m |
| 46 |
| 22m |
| 23 |
故选C.
点评:本题考查了钠及钠与盐溶液反应的实质,注意计算增重时减去沉淀的质量,根据方程式利用差量法分析反应后溶液质量的变化是解答的关键,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目