题目内容
短周期元素W、X、Y和Z的原子序数依次增大。元素W是形成化合物数量众多,且分布极广的元素,X原子的最外层电子数是其电子层数的3倍,元素Y是地壳中含量最丰富的金属元素,Z元素的单质易溶于WZ2中。下列说法错误的是( )
A. 元素X、Y与Z的原子半径大小:Y>Z>X
B. 元素W、Z的氯化物中,化学键类型相同,且各原子均满足8电子
C. 元素X与元素Y形成的化合物是一种较好的耐火材料
D. 元素X可与元素Z可组成3种二价阴离子
 春雨教育同步作文系列答案
春雨教育同步作文系列答案某校化学课外学习小组发现将镁粉按图投入纯水中现象不明显,而投入氯化铵溶液中,两者立即发生反应,产生大量气泡。经检验该过程产生两种气体,其中一种气体有刺激性气味。
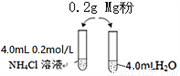
(1)实验开始时用校准过的pH传感器测定纯水的pH,发现纯水的pH总是在7.30左右,其原因可能是_____________________
(2)请设计简单的实验方案检验上述实验中有刺激性气味的气体:__________________
(3)实验中0.2mol/L氯化铵溶液的pH为5.90,请用离子方程式解释原因:_________________
(4)该小组同学为探究镁与氯化铵溶液反应的原因设计了如下实验方案:
序号 | 实验试剂 | 实验现象 | |
实验1-1 | 0.20g镁粉 | 3.0mL 0.2mol/LNH4Cl溶液 | 反应明显,有气泡产生 |
实验1-2 | 0.20g镁粉 | 3.0mL盐酸 | 反应不明显,几乎没有气泡产生 |
①上述探究实验1-2选用的盐酸为_____________(填字母)。
A、1 mol·L-1 B、pH=1.0 C、0.2 mol·L-1 D、pH=5.90
②通过实验对比,说明NH4Cl 水解产生的H+ 对反应影响_____NH4+ 对反应影响(填“小于”、“大于”或“等于”)。
(5)该小组同学继续探究镁粉与氯化铵溶液反应剧烈的影响因素。
实验序号 | 实验试剂 | |
实验2-1 | 0.20g镁粉 | ________________ |
实验2-2 | 0.20g镁粉 | _________________ |
实验3-1 | 0.20g镁粉 | 3.0mL0.2mol/L NH4NO3溶液 |
实验3-2 | 0.20g镁粉 | 3.0mL0.2mol/L KNO3溶液 |
①实验2-1与实验2-2中实验现象说明Cl-对反应速率的影响很小,请补充完成实验方案所需的试剂。
②实验3-1与实验3-2的结论说明NH4+对反应速率影响很大,则两支试管中实验现象的不同之处是___________________
(6)写出镁与氯化铵溶液反应生成Mg2+的离子方程式_______________。
地球表面十公里厚的地层中,含钛元素达千分之六,比铜多61倍,金属钛(Ti)被誉为21世纪金属,其单质和化合物具有广泛的应用价值。氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金的代替品。以TiCl4为原料,经过一系,列反应可以制得Ti3N4和纳米TiO2(如下图)。
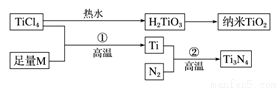
图中的M是短周期金属元素,M的部分电离能如下表:
I1 | I2 | I3 | I4 | I5 | |
电离能/(kJ·mol-1) | 738 | 1451 | 7733 | 10 540 | 13 630 |
请回答下列问题:
⑴TiO2为离子晶体,己知晶体中阳离子的配位数为6,阴离子的配位数为3,则阳离子的电子排布式为___________
⑵金属Ti与金属M的晶体原子堆积模式相同,其堆积模型为_________(填写堆积模型名称),晶体中原子在二维平面里的配位数为_____________
⑶室温下TiCl4为无色液体,沸点为136.4℃,由此可知其晶体类型为__________,构成该晶体的粒子的空间构型为_____________
(4)有一种氮化钛晶体的晶胞与NaCl晶胞相似,如下图所示,已知该氮化钛的密度为p g·cm-3,则该晶胞中N、Ti之间的最近距离为_____ pm,(NA为阿伏加德常数的数值,只列算式)。该晶体中与Ti原子距离相等且最近的Ti原子有___________个。
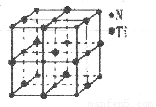
(5)科学家通过X射线探明KC1、MgO、CaO、TiN的晶体与NaCl的晶体结构相似。且知三种离子晶体的晶格能数据如下:
离子晶体 | NaCl | KC1 | CaO |
晶格能/(kJ·mol-1) | 786 | 715 | 3401 |
KC1、CaO、TiN三种离子晶体硬度由低到该的顺序为_____________
下列实验操作、现象和结论均正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 用洁净铂丝蘸取溶液进行焰色反应 | 火焰呈黄色 | 原溶液中有Na+、无K+ |
B | C2H5OH与浓硫酸170℃共热,制得的气体通入酸性KMnO4溶液 | KMnO4溶液褪色 | 使KMnO4溶液褪色的气体一定是乙烯 |
C | 铜放入稀硫酸中,再加入硝酸钠固体 | 开始无明显现象,后溶液变蓝,有气泡放出,铜溶解 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
D | 向浓度均为0.1 mol/L NaCl和Nal混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D



 ),下列有关联苯的说法中正确的是( )
),下列有关联苯的说法中正确的是( ) )同属于芳香烃,两者互为同系物
)同属于芳香烃,两者互为同系物