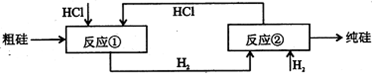
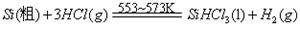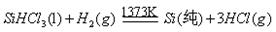题目内容
重铬酸钠(Na2Cr2O7)广泛用作氧化剂、鞣革剂等。以铬矿石(主要成分为
03,还含有FeO、A1203、Si02等杂质)为原料制取重铬酸钠的流程如下:

请回答下列问题:
(1)Cr203在高温焙烧时反应的化学方程式为 。
(2)生产过程中,调节(含Na2Cr04、Na2Si03、NaAl02
的溶液)pH的目的是 。
(3)某化工厂采用石墨作电极电解Na2Cr04溶液,实现了
Na2Cr04转化为Na2Cr207的生产,其原理如下图所示。
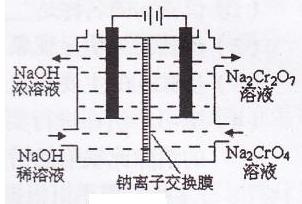
①写出阳极的电极方程式: ;
②此生产方法和上述流程相比的优点主要有 。
(4)Na2Cr207可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被
氧化所需要的02的质量)。现有某水样100.00 mL,酸化后加入cl mol/L。的
Na2Cr207溶液 mL,使水中的还原性物质完全被氧化(还原产物为
mL,使水中的还原性物质完全被氧化(还原产物为 );再用
);再用
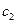
 的FeS04溶液滴定剩余的
的FeS04溶液滴定剩余的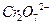 ,结果消耗FeS04溶液
,结果消耗FeS04溶液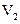 mL。则该水
mL。则该水
样的COD为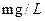 。
。
03,还含有FeO、A1203、Si02等杂质)为原料制取重铬酸钠的流程如下:

请回答下列问题:
(1)Cr203在高温焙烧时反应的化学方程式为 。
(2)生产过程中,调节(含Na2Cr04、Na2Si03、NaAl02
的溶液)pH的目的是 。
(3)某化工厂采用石墨作电极电解Na2Cr04溶液,实现了
Na2Cr04转化为Na2Cr207的生产,其原理如下图所示。

①写出阳极的电极方程式: ;
②此生产方法和上述流程相比的优点主要有 。
(4)Na2Cr207可用于测定废水的化学耗氧量(即COD,指每升水样中还原性物质被
氧化所需要的02的质量)。现有某水样100.00 mL,酸化后加入cl mol/L。的
Na2Cr207溶液
 mL,使水中的还原性物质完全被氧化(还原产物为
mL,使水中的还原性物质完全被氧化(还原产物为 );再用
);再用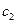
 的FeS04溶液滴定剩余的
的FeS04溶液滴定剩余的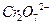 ,结果消耗FeS04溶液
,结果消耗FeS04溶液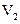 mL。则该水
mL。则该水样的COD为
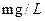 。
。(1)2Cr2O3 + 4Na2CO3 + 3O2 4Na2CrO4 + 4CO2
(2)使SiO32—、AlO2—生成H2SiO3和Al(OH)3沉淀
(3)①4OH― ― 4e-= O2↑+ 2H2O
② 不引入其他离子(或物质),同时副产氢气和NaOH等
(4)480c1V1 — 80 c2V2
(2)使SiO32—、AlO2—生成H2SiO3和Al(OH)3沉淀
(3)①4OH― ― 4e-= O2↑+ 2H2O
② 不引入其他离子(或物质),同时副产氢气和NaOH等
(4)480c1V1 — 80 c2V2
略

练习册系列答案
相关题目
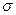 键处1个
键处1个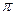 键
键 >CO2
>CO2 5SH>C2H5OH
5SH>C2H5OH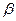 -ZnS的晶胞结构如右图,晶胞中S2-数目为: 个。
-ZnS的晶胞结构如右图,晶胞中S2-数目为: 个。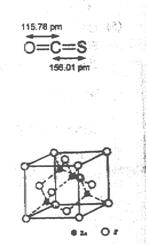

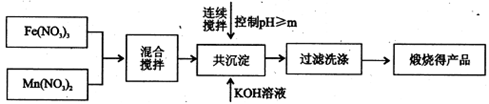
 (3)不同铌酸用量对产率和转化率影响,如下表:
(3)不同铌酸用量对产率和转化率影响,如下表: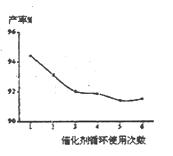
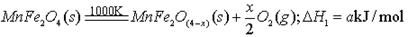
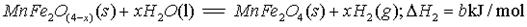
 (填字母编号)。
(填字母编号)。 B.物料可循环使用
B.物料可循环使用