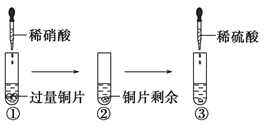
��Ŀ����
����Ŀ��ͼ�У�AΪһ����ѧ��ѧ�г����ĵ��ʣ�B��C��D��E�Ǻ���AԪ�صij�����������ǵ���ɫʵ���Ϊ��ɫ��
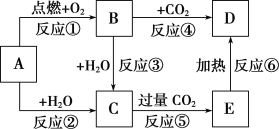
��1��д���������ʵĻ�ѧʽ��B___��
��2������6����Ӧ������������ԭ��Ӧ����___(��д���)��
��3��д��A ��C��Ӧ�����ӷ���ʽ___��
��4��д��B��C��Ӧ�����ӷ���ʽ��___��E��D�Ļ�ѧ����ʽ��___��
��5������5.00gD��E�Ĺ������ʹE��ȫ�ֽ⣬�������������������0.31g����ԭ�������D����������Ϊ___��
���𰸡�Na2O2 �٢ڢۢ� 2Na+2H2O=2Na++2OH-+H2�� 2Na2O2��2H2O��4Na����4OH����O2�� 2NaHCO3![]() Na2CO3��CO2����H2O 83.2%
Na2CO3��CO2����H2O 83.2%
��������
AΪһ����ѧ��ѧ�г����ĵ��ʣ���ɫʵ��Ϊ��ɫ����AΪNa��Na��������ȼʱ���ɹ������ƣ���BΪNa2O2�����������������̼��Ӧ����̼���ƣ���DΪ̼���ƣ�Na��ˮ��Ӧ����C����CΪNaOH��NaOH������Ķ�����̼��Ӧ����̼�����ơ�
��1��������֪��BΪ�������ƣ���ѧʽΪNa2O2��
��2��Na��ˮ��������Ӧʱ�����ϼ۷����ı䣬Ϊ������ԭ��Ӧ�����������������̼��ˮ��Ӧ���ɵ������������ϼ۸ı䣬Ϊ������ԭ��Ӧ��NaOH�������̼��̼����������̼���ƻ��ϼ�δ�䣬Ϊ��������ԭ��Ӧ��
��3��A ��C�ֱ�ΪNa��NaOH��Na��ˮ��Ӧ�����������ƺ����������ӷ���ʽΪ2Na+2H2O=2Na++2OH-+H2����
��4������������ˮ��Ӧ�����������ƺ����������ӷ���ʽΪ2Na2O2��2H2O��4Na����4OH����O2����̼���������ȷֽ�����̼���ơ�������̼��ˮ������ʽΪ2NaHCO3![]() Na2CO3��CO2����H2O��
Na2CO3��CO2����H2O��
��5�����ݷ���ʽ���ٵ�����Ϊ1��1��CO2��H2O����n��NaHCO3��=2n��CO2��=![]() =0.005mol��2��m��NaHCO3��=0.010mol��84g/mol=0.84g��m��Na2CO3��=5.00g-0.84g=4.16g��Na2CO3��������Ϊ
=0.005mol��2��m��NaHCO3��=0.010mol��84g/mol=0.84g��m��Na2CO3��=5.00g-0.84g=4.16g��Na2CO3��������Ϊ![]() ��100%=83.2%��
��100%=83.2%��

����Ŀ��ijͬѧ����ˮ�ʼ��վ����480 mL 0.5 mol��L-1NaOH��Һ�Ա�ʹ�á�


(1)��ͬѧӦѡ��____mL������ƿ��
(2)�����������ͼ��ʾ������ͼ���в���Ӧ��ͼ��__________ (��ѡ����ĸ)֮�䡣
A.����ۡ�������B.����ڡ�������C.�����
(3)��ͬѧӦ��ȡNaOH����____g��������Ϊ23.1 g���ձ�����������ƽ�ϳ�ȡ����NaOH����ʱ�����ڸ�����ѡȡ����������С____(����ĸ)��������ͼ��ѡ������ȷ��ʾ����λ�õ�ѡ��____(����ĸ)��
���� ������
a | b | c | d | e | |
�����С/g | 100 | 50 | 20 | 10 | 5 |

(4)���в�����������Һ��Ũ�ȴ�С�к�Ӱ��(�ƫ�� ��ƫС������Ӱ�족����
�ٶ���ʱ�����Ӷ�����Ũ�Ȼ�________����ת����Һ�����У�����Һ�彦������Ũ�Ȼ�____________��
������ƿδ���Ũ�Ȼ�__________��
�ܶ���ҡ�Ⱥ�����Һ������ڿ̶��ߣ�Ũ�Ȼ�______________��