题目内容
钢铁工业是国家工业的基础。2006年我国粗钢产量突破4亿t,居世界首位。某中学社会实践活动小组利用假期对当地钢铁厂进行了调研,对从矿石开始到钢铁产出的工艺流程有了全面的感性认识。请您对社会实践活动小组感兴趣的问题进行计算:
(1)将6.62g铁矿石样品投入适量的盐酸中(充分反应),过滤,然后在滤液中加过量的NaOH溶液,充分反应后,过滤、洗涤、灼烧得4.80g![]() 。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)
。现以该铁矿石为原料炼铁,若生产过程中铁元素损失4%,计算每生产1.00t生铁(含铁96%),至少需要这种铁矿石多少吨?(保留两位小数)
(2)取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到![]() 气体
气体
224mL。(标准状况)。
①计算此钢样粉末中铁和碳的物质的量之比。
②再取三份不同质量的钢样粉末分别加到l00mL相同浓度的![]() 。溶液中,充分反应后,测得的实验数据如下表所示:
。溶液中,充分反应后,测得的实验数据如下表所示:
| 实验序号 | I | Ⅱ | Ⅲ |
| 加入钢样粉末的质量/g | 2.812 | 5.624 | 8.436 |
| 生成气体的体积/L(标准状况) | 1.120 | 2.240 | 2.800 |
计算硫酸溶液的物质的量浓度。
③若在实验Ⅱ中继续加入mg钢样粉末,计算反应结束后剩余的固体质量为多少?(用含m的代数式表示)
(1)解:6.62g铁矿石中铁的质量为
![]()
生产l.00t生铁需要铁矿石的质量为:
m(铁矿石)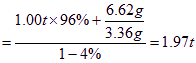
答:至少需要这种铁矿石1.97t。
(2)
①![]()
![]()

答:此钢样粉末中铁和碳的物质的量之比为50:1。
②根据实验Ⅲ可得:
![]()
1mol 22.4L
![]() 2.800L
2.800L
![]()
![]()
答:硫酸溶液的物质的量量浓度为![]()
③当钢样粉末中的铁未全部溶解时(![]() ),剩余的固体质量为:
),剩余的固体质量为:
![]()
当钢样粉末中的铁全部溶解时(![]() ),
),
剩余的固体质量为:![]()
答:当铁未完全溶解时,剩余固体的质量为![]() ;当铁完全溶解时,剩余固体的质量为
;当铁完全溶解时,剩余固体的质量为![]()
解析:
(1)解:6.62g铁矿石中铁的质量为
![]()
生产l.00t生铁需要铁矿石的质量为:
m(铁矿石)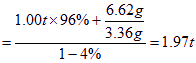
答:至少需要这种铁矿石1.97t。
(2)
①![]()
![]()
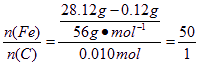
答:此钢样粉末中铁和碳的物质的量之比为50:1。
②根据实验Ⅲ可得:
![]()
1mol 22.4L
![]() 2.800L
2.800L
![]()
![]()
答:硫酸溶液的物质的量量浓度为![]()
③当钢样粉末中的铁未全部溶解时(![]() ),剩余的固体质量为:
),剩余的固体质量为:
![]()
当钢样粉末中的铁全部溶解时(![]() ),
),
剩余的固体质量为:![]()
答:当铁未完全溶解时,剩余固体的质量为![]() ;当铁完全溶解时,剩余固体的质量为
;当铁完全溶解时,剩余固体的质量为![]()




