题目内容
10g下列金属与100ml 1mol/L 的盐酸反应,产生气体物质的量最多的是( )
| A.Na | B.Mg | C.Fe | D.Al |
A
试题分析:根据题意知,100ml 1mol/L 的盐酸中HCl的物质的量为0.1mol,10gNa、Mg、Fe、Al的物质的量分别为10/23mol、10/24mol、10/56mol、10/27mol,根据四种金属与盐酸反应的化学方程式判断,金属过量,根据盐酸的物质的量减少产生氢气的物质的量,Mg、Fe、Al产生氢气的物质的量相同,均为0.05mol;但过量的钠与水反应也产生氢气,故钠产生的氢气最多,选A。

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
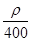 mol·L-1
mol·L-1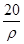 mol·L-1
mol·L-1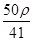 mol·L-1
mol·L-1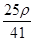 mol·L-1
mol·L-1
 (4)含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
(4)含铬化合物有毒,对人畜危害很大.因此含铬废水必须进行处理才能排放.
