题目内容
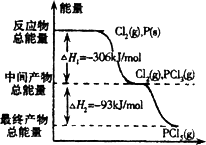
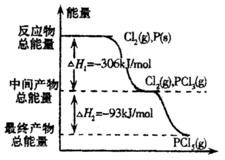
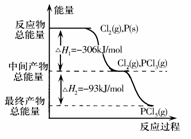
如图是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程和能量关系图。其中PCl5(g)分解成PCl3(g)和Cl2(g)的反应是一个可逆反应,温度T℃时,在密闭容器中加入0.6 mol PCl5,达平衡时PCl5还剩0.45mol,其分解率为α,则下列推断不正确的是( )
A.α等于25%
B.若升高温度,平衡时PCl5的分解率小于α
C.若超始时加入0.6 mol PCl3和0.6 mol C12,以相同条件进行反应,则平衡时PCl3
转化率为3α
D.PCl5分解的热化学方程式为PCl5(g)![]() PCl3(g)+C12(g)△H =-93 kJ·mol-1
PCl3(g)+C12(g)△H =-93 kJ·mol-1
BD

练习册系列答案
 华东师大版一课一练系列答案
华东师大版一课一练系列答案
相关题目
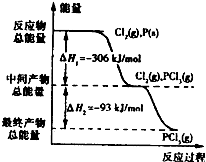 如图是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程和能量关系图.其中PCl5(g)分解成PCl3(g)和Cl2(g)的反应是一个可逆反应,温度T℃时,在密闭容器中加入0.6mol PCl5,达平衡时,PCl5还剩0.45mol,其分解率为α,则下列推断不正确的是( )
如图是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程和能量关系图.其中PCl5(g)分解成PCl3(g)和Cl2(g)的反应是一个可逆反应,温度T℃时,在密闭容器中加入0.6mol PCl5,达平衡时,PCl5还剩0.45mol,其分解率为α,则下列推断不正确的是( )| A、α等于25% | B、若升高温度,平衡时PCl5的分解率小于α | C、若初始时加入0.6mol PCl3和0.6 mol Cl2,以相同条件进行反应,则平衡时PCl3转化率为3α | D、PCl5分解的热化学方程式为:PCl5(g)?PCl3(g)+Cl2(g)△H=-93kJ?mol-1 |
|
如图是红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)的反应过程和能量关系图.其中PCl5(g)分解成PCl3(g)和Cl2(g)的反应是一个可逆反应,温度t℃时,在密闭容器中加入0.6 mol PCl5,达平衡时PCl5还剩0.45 mol,其分解率为α,则下列推断不正确的是
| |
| [ ] | |
A. |
α等于25% |
B. |
若升高温度,平衡时PCl5的分解率大于α |
C. |
若超始时加入0.6 mol PCl3和0.6 mol Cl2,以相同条件进行反应,则平衡时PCl3转化率为3α |
D. |
PCl5分解的热化学方程式为PCl5(g) |