题目内容
【题目】已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+1/2O2(g);△H=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是
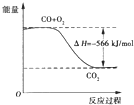
A.CO的燃烧热为283kJ
B.如图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) △H<-452kJ/mol
D.CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为6.02×1023
【答案】C
【解析】
试题分析:A.CO的燃烧热为283 kJ/mol,故A错误;B.该图描述的就是一个热化学方程式,所以对应566的数值应该是2CO(g)+O2(g)和2CO2,上边的系数不对,故B错误;C.题目中第二个方程的2倍为:2Na2O2(s)+2CO2(g)=2Na2CO3(s)+O2(g)△H=-452 kJ/mol,本题中的CO2(s)多一步变气体吸热的过程,所以本题放出的热量就少于452,△H<-452 kJ/mol,故C正确;D.题目中![]() 式为:Na2O2(s)+CO(g)=Na2CO3(s)△H=-509 kJ/mol,此时放热509KJ,因为CO是1mol,所以转移电子数是2倍的6.02×1023,故D错误;故选C。
式为:Na2O2(s)+CO(g)=Na2CO3(s)△H=-509 kJ/mol,此时放热509KJ,因为CO是1mol,所以转移电子数是2倍的6.02×1023,故D错误;故选C。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某化学兴趣小组为了探究铝电极在原电池中的作用,设计并进行了以下一系列实验,实验结果记录如下。
编号 | 电极材料 | 电解质溶液 | 电流表指针偏转方向 |
1 | Al、Mg | 稀盐酸 | 偏向Al |
2 | Al、Cu | 稀盐酸 | 偏向Cu |
3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
4 | Al、Mg | 氢氧化钠溶液 | 偏向Mg |
5 | Al、Zn | 浓硝酸 | 偏向Al |
试根据上表中的实验现象回答下列问题:
(1)实验1、2中Al所作的电极(正极或负极)是否相同____________(填“是”或“否”)。
(2)对实验3完成下列填空:
①石墨为________极,电极反应式:__________________________________________。
②电池总反应式:____________________________________________。
(3)实验4中铝作_____极,写出铝电极的电极反应式:________________________。