题目内容
氨的催化氧化4NH3(g)+5O2(g) 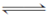 4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1是工业制备硝酸的重要反应。一定条件下将4 mol NH3和5 mol O2混合于固定容积为2 L的密闭容器中,经10 s该反应达平衡,并测得NO的浓度为0.8 mol·L-1。下列判断正确的是( )。
4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1是工业制备硝酸的重要反应。一定条件下将4 mol NH3和5 mol O2混合于固定容积为2 L的密闭容器中,经10 s该反应达平衡,并测得NO的浓度为0.8 mol·L-1。下列判断正确的是( )。
| A.以O2浓度变化表示的反应速率为0.064 mol·(L·s)-1 |
| B.反应达到平衡状态时NH3的转化率为20% |
C.升高温度能使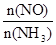 减小 减小 |
| D.将容器的体积变为4 L,平衡时NO的浓度小于0.4 mol·L-1 |
C
解析试题分析: 4NH3(g)+5O2(g) 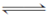 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
起始浓度(mol/L) 2 2.5 0 0
转化浓度(mol/L) 0.8 1.0 0.8 0.8
平衡浓度(mol/L) 1.2 1.5 0.8 0.8
则以O2浓度变化表示的反应速率为0.1 mol·(L·s)-1,A不正确;反应达到平衡状态时NH3的转化率为40%,B不正确;升高温度平衡向逆反应方向移动,则能使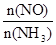 减小,C正确。将容器的体积变为4 L,平衡向正反应方向移动,平衡时NO的浓度大于0.4 mol·L-1,D不正确,答案选C。
减小,C正确。将容器的体积变为4 L,平衡向正反应方向移动,平衡时NO的浓度大于0.4 mol·L-1,D不正确,答案选C。
考点:考查可逆反应的有关计算以及外界条件对平衡状态的影响
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生解题方法与技巧的培养与训练,有利于培养学生的逻辑推理能力,提高学生的应试能力和学习效率。

练习册系列答案
相关题目


 4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1是工业制备硝酸的重要反应。一定条件下将4 mol NH3和5 mol O2混合于固定容积为2 L的密闭容器中,经10 s该反应达平衡,并测得NO的浓度为0.8 mol·L-1。下列判断正确的是( )。
4NO(g)+6H2O(g) ΔH=-1 025 kJ·mol-1是工业制备硝酸的重要反应。一定条件下将4 mol NH3和5 mol O2混合于固定容积为2 L的密闭容器中,经10 s该反应达平衡,并测得NO的浓度为0.8 mol·L-1。下列判断正确的是( )。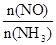 减小
减小