题目内容
某种胃药片的制酸剂为碳酸钙,其中所含的制酸剂质量的测定如下:①配制0.1 mol·L-1的HCl溶液和0.1 mol·L-1的NaOH溶液;②每次取一粒(药片质量均相同)0.2 g的此胃药片,磨碎后加入20 mL蒸馏水;③以酚酞为指示剂,用0.1 mol·L-1的NaOH溶液滴定,需用去Vx mL达滴定终点;④加入25 mL 0.1 mol·L-1的HCl溶液。
(1)写出全部实验过程的步骤____________(写编写顺序)。

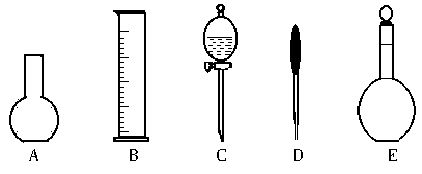
(2)上图所示的仪器中配制0.1 mol·L-1的HCl溶液和0.1 mol·L-1的NaOH溶液肯定不需要的仪器是____________(填序号),配制上述溶液还需用到的玻璃仪器是____________(填仪器名称)。
(3)配制上述溶液应选用的容量瓶规格分别为____________(填字母)。( )
A.50 mL,50 mL B.100 mL,100 mL
C.100 mL,150 mL D.250 mL,250 mL
(4)如果对装有浓盐酸的量筒读数如图读取,配制的稀盐酸的浓度将____________(填“偏高”“偏低”或“无影响”)。如果对容量瓶也如图读取,配制的稀盐酸的浓度将____________(填“偏高”“偏低”或“无影响”)。

(5)写出相关的化学反应方程式:____________________________________________。
(6)胃药中含碳酸钙的质量为:____________ g。(写出计算式并加以文字说明)。
(1)①②④③②④③或②①④③②④③
(2)AC 烧杯、玻璃棒 (3)B
(4)偏高 偏低
(5)CaCO3+2HCl====CaCl2+H2O+CO2↑
HCl+NaOH====NaCl+H2O
(6)平行操作实验2次或3次;
![]()
![]() 或
或![]()

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
| |||||||||||||||||||||||||||||||||