题目内容
【题目】某同学设计了如下装置用于制取 SO2 和验证 SO2 的性质。
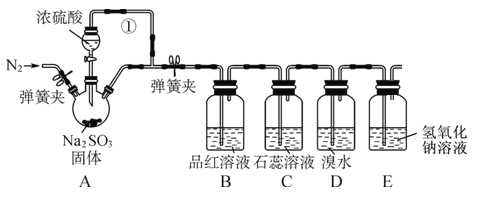
试回答以下问题:
(1)装置 A 中用于添加浓硫酸的仪器名称为____,其中反应的化学方程式为____。
(2)导管①的作用是____。
(3)装置 B 中可观察到的现象是____,体现出 SO2 ____性。
(4)装置 D 中溴水褪色,体现出 SO2 ____性。
(5)E 装置的作用是 ____,发生反应的离子方程式为____。
【答案】分液漏斗 H2SO4 + Na2SO3 = Na2SO4 + SO2↑ + H2O 平衡气压,便于浓硫酸顺利滴下 品红溶液褪色 漂白 还原 吸收SO2气体,防止污染空气 2OH—+ SO2 = SO32—+ H2O(或OH—+ SO2 = HSO3—)
【解析】
(1)根据仪器的结构及反应原理判断;
(2)导管的作用是平衡气压;
(3)SO2具有漂白性;
(4)SO2 具有还原性;
(5)二氧化硫为污染性气体,不能直接排放到空气中。
(1)根据仪器的结构可知,装置 A 中用于添加浓硫酸的仪器名称为分液漏斗,其中发生的反应为亚硫酸钠与浓硫酸反应生成硫酸钠、二氧化硫和水,反应的化学方程式为H2SO4 + Na2SO3 = Na2SO4 + SO2↑ + H2O;
(2)若没有导管①平衡压强,分液漏斗内液体不能够顺利流下,故导管①的作用是平衡气压,便于浓硫酸顺利滴下;
(3)因SO2具有漂白性,装置 B 中可观察到的现象是品红溶液褪色;
(4)因 SO2 具有还原性,与溴发生氧化还原反应而使溴水褪色,则装置 D 中溴水褪色;
(5)二氧化硫为污染性气体,不能直接排放到空气中,故E 装置的作用是吸收SO2气体,防止污染空气,发生反应的离子方程式为2OH—+ SO2 = SO32—+ H2O或OH—+ SO2 = HSO3—。

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案