题目内容
下列离子方程式正确的是( )A.用KIO3氧化酸性溶液中的KI:5I-+IO-3+3H2O═3I2+6OH-
B.硅酸钠溶液与醋酸溶液混合:
 +2H+═H2SiO3↓
+2H+═H2SiO3↓C.向Ba(OH)2溶液中逐滴加入明矾溶液,至生成沉淀的物质的量最大时:2Al3++3
 +3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓
+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓D.浓硝酸中加入过量铁粉并加热:Fe+3
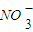 +6H+
+6H+ Fe3++3NO2↑+3H2O
Fe3++3NO2↑+3H2O
【答案】分析:A、依据化合价升降守恒,原子守恒、电荷守恒分析判断;
B、醋酸是弱电解质,不能拆成离子;
C、向Ba(OH)2溶液中逐滴加入明矾溶液,至生成沉淀的物质的量最大时应是铝离子恰好沉淀;
D、过量铁粉产物中生成亚铁离子.
解答:解:A、KIO3氧化酸性溶液中的KI产物中不能生成氢氧根离子,反应的离子方程式为:5I-+IO-3+6H+═3I2+3H2O;故A错误;
B、醋酸是弱酸离子方程式中写分子式,不能拆成离子,故B错误;
C、向Ba(OH)2溶液中逐滴加入明矾溶液,至生成沉淀的物质的量最大时应是铝离子恰好沉淀,离子方程式为:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓故C正确;
D、浓硝酸中加入过量铁粉并加热生成亚铁离子:Fe+2NO3-+4H+ Fe2++2NO2↑+2H2O;故D错误;
Fe2++2NO2↑+2H2O;故D错误;
故选C.
点评:本题考查了离子方程式的注意问题和正误判断方法,主要考查氧化还原反应的判断.弱电解质的书写原则,量不同产物不同的定量分析.
B、醋酸是弱电解质,不能拆成离子;
C、向Ba(OH)2溶液中逐滴加入明矾溶液,至生成沉淀的物质的量最大时应是铝离子恰好沉淀;
D、过量铁粉产物中生成亚铁离子.
解答:解:A、KIO3氧化酸性溶液中的KI产物中不能生成氢氧根离子,反应的离子方程式为:5I-+IO-3+6H+═3I2+3H2O;故A错误;
B、醋酸是弱酸离子方程式中写分子式,不能拆成离子,故B错误;
C、向Ba(OH)2溶液中逐滴加入明矾溶液,至生成沉淀的物质的量最大时应是铝离子恰好沉淀,离子方程式为:2Al3++3SO42-+3Ba2++6OH-═3BaSO4↓+2Al(OH)3↓故C正确;
D、浓硝酸中加入过量铁粉并加热生成亚铁离子:Fe+2NO3-+4H+
 Fe2++2NO2↑+2H2O;故D错误;
Fe2++2NO2↑+2H2O;故D错误;故选C.
点评:本题考查了离子方程式的注意问题和正误判断方法,主要考查氧化还原反应的判断.弱电解质的书写原则,量不同产物不同的定量分析.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目