题目内容
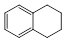
1,2,3,4—四氢化萘的结构简式如下图, 分子式是C10H12。常温下为无色液体,有刺激性气味,沸点207℃,不溶于水,是一种优良的溶剂,它与液溴发生反应:C10H12+ 4Br2→ C10H8Br4+ 4HBr生成的四溴化萘常温下为固态,不溶于水,有人用四氢化萘、液溴、蒸馏水和纯铁粉为原料,制备少量饱和氢溴酸溶液,实验步骤如下:

①按一定质量比把四氢化萘和水加入适当的容器中,加入少量纯铁粉。
②慢慢滴入液溴,不断搅拌,直到反应完全。
③取下反应容器,补充少量四氢化萘,直到溶液颜色消失。过滤,将滤液倒入分液漏斗,静置。
④ 分液,得到的“水层”即氢溴酸溶液。
回答下列问题:
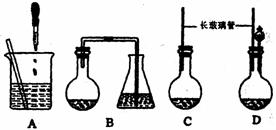
(1) 如图所示的装置, 适合步骤①和②的操作的是 。
(2) 步骤②中如何判断“反应完全”_________________________________________。
(3) 步骤③中补充少量四氢化萘的目的是 。
(4) 步骤③中过滤后得到的固体物质是____________ _________。
(5) 已知在实验条件下,饱和氢溴酸溶液中氢溴酸的质量分数是66%,如果溴化反应进行完全,则步骤①中水和四氢化萘的质量比约是1:____________(保留小数点后1位)。
⑴ A ⑵ 溶液由无色→橙色(橙红) ⑶除去过多的溴单质
⑷ 四溴化萘 ⑸ 0.8
【解析】
试题分析:(1) 根据所给的操作要点可知,适合步骤①和②的操作的是A选项。
(2) 由于液溴在溶液中是有颜色,所以步骤②中判断“反应完全”的方法是溶液由无色→橙色(橙红)。
(3)由于反应中溴单质是过量的,所以步骤③中补充少量四氢化萘的目的是除去过多的溴单质。
(4)生成的四溴化萘常温下为固态,不溶于水,所以步骤③中过滤后得到的固体物质是四溴化萘。
(5)饱和氢溴酸溶液中氢溴酸的质量分数是66%,如果设溶液的质量是100g,则溶液中HBr的质量是66g,水的质量是34g。根据反应的化学方程式C10H12+
4Br2 C10H8Br4+ 4HBr可知,生成66gHBr需要四氢化萘的质量是
C10H8Br4+ 4HBr可知,生成66gHBr需要四氢化萘的质量是 ,所以步骤①中水和四氢化萘的质量比约是1:0.8。
,所以步骤①中水和四氢化萘的质量比约是1:0.8。
考点:考查有机物制备实验的有关判断
点评:该题综合性强,难度较大,对学生的综合素质提出了更高的要求,有助于培养学生规范的实验设计、操作能力。该制备性实验的试题,综合性强,理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案