题目内容
【题目】下列有关实验说法不正确的是
A. 在两支试管中分别加1 mL无水乙醇和1.5 g苯酚固体,再加等量等体积的钠,比较乙醇、苯酚羟基上氢原子的活泼性
B. 向少量的火柴头浸泡液中滴加AgNO3、稀HNO3和NaNO2,检验火柴头中的氯元素
C. 在2mL紫色的COCl2溶液中加入浓盐酸,可使溶液显蓝色
D. 制备摩尔盐时,最后在蒸发皿中蒸发浓缩溶液,加热至液体表面出现晶膜为止,不能将溶液全部蒸干
【答案】A
【解析】本题考查化学实验方案的设计及评价。乙醇是液体,与钠接触面积大,苯酚固体与钠接触面积小,无法比较乙醇、苯酚羟基上氢原子的活泼性,A错误;火柴头浸泡液中含![]() ,加入NaNO2,发生氧化还原反应,
,加入NaNO2,发生氧化还原反应,![]() 被还原为Cl-,再滴入稀硝酸和硝酸银溶液,可以生成白色沉淀,B正确;氯化钴溶液中存在如下平衡Co
被还原为Cl-,再滴入稀硝酸和硝酸银溶液,可以生成白色沉淀,B正确;氯化钴溶液中存在如下平衡Co![]() (蓝色)+6H2O
(蓝色)+6H2O![]() Co
Co![]() (粉红色)+4Cl-,溶液中加入浓盐酸,由于氯离子浓度增大,使平衡向逆反应方向移动,溶液由粉红色变为蓝色,故C正确;D.将蒸发皿置于水浴上蒸发、浓缩至表面出现结晶薄膜为止,放置冷却,得(NH4)2SO4FeSO46H2O晶体,不能将溶液全部蒸干,以防得不到(NH4)2SO4FeSO46H2O晶体,故D正确,故选A。
(粉红色)+4Cl-,溶液中加入浓盐酸,由于氯离子浓度增大,使平衡向逆反应方向移动,溶液由粉红色变为蓝色,故C正确;D.将蒸发皿置于水浴上蒸发、浓缩至表面出现结晶薄膜为止,放置冷却,得(NH4)2SO4FeSO46H2O晶体,不能将溶液全部蒸干,以防得不到(NH4)2SO4FeSO46H2O晶体,故D正确,故选A。

 阅读快车系列答案
阅读快车系列答案【题目】某探究学习小组用如图所示装置进行SO2、Fe2+和Cl-还原性强弱比较实验,实验过程如下:

Ⅰ.先向B中的FeCl2溶液(约10mL)中通入Cl2,当B中溶液变黄时,停止通气。
Ⅱ.打开活塞b,使约2mL的溶液流入D试管中,检验取出溶液中的离子。
Ⅲ.接着再向B中通入一定量的SO2气体。
Ⅳ.更新试管D,重复过程Ⅱ,检验取出溶液中的离子。
(1)棉花中浸润的溶液为____________,目的是________________。
(2)实验室制备氯气的化学方程式为______________________。
(3)过程Ⅲ中一定发生反应的离子方程式为______________________,过程Ⅳ中检验取出溶液中是否含有硫酸根的操作是_____________________。
(4)该小组对SO2、Fe2+和Cl-还原性强弱比较期望达到的结论是_______________。
(5)甲、乙、丙三同学分别完成了上述实验,下表是他们的检测结果,他们的检测结果一定能够证明SO2、Fe2+和Cl-还原性强弱关系的是______________。
过程Ⅱ中检出离子 | 过程Ⅳ中检出离子 | |
甲 | 有Fe3+无Fe2+ | 有SO42- |
乙 | 既有Fe3+又有Fe2+ | 有SO42- |
丙 | 有Fe3+无Fe2+ | 有Fe2+ |
【题目】表是前20号元素中的部分元素的一些数据:
A | B | C | D | E | F | G | H | I | J | |
原子半径(10﹣10 m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
最高价态 | +6 | +1 | ﹣ | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
最低价态 | ﹣2 | ﹣ | ﹣2 | ﹣ | ﹣4 | ﹣3 | ﹣1 | ﹣ | ﹣3 | ﹣4 |
试回答下列问题:
(1)以上10种元素电负性最大的是_____(填元素符号).比元素B原子序数大7的元素在元素周期表中的位置:第____________,其基态原子的核外电子排布式是___________.
(2)H、I、J三种元素对应单质的熔点依次升高的顺序是(用单质的具体化学式排序)______.
(3)元素E与C及氢元素可形成一种相对分子质量为60的一元羧酸分子.其分子中共形成σ键与π键之比_________;I与氢元素形成的10电子分子X的空间构型为_____。
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为_______;该晶体中,原子之间的作用力是__________;上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2结构相似,该晶体储氢后的化学式应为___________ 。
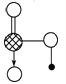
(5)如图是I元素形成的含氧酸的结构,请简要说明该物质易溶于水的原因:_______________
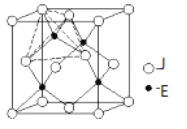
(6)如图是J和E组成的晶体结构,则每个与J周围最近J原子数目为___,若晶胞边长为a pm,则晶体的密度为(用含a、NA的代数式表示)________________(g/mL)。