题目内容
由于用氯气对饮用水消毒,会使水中的有机物发生氯化,生成有机含氯化合物于人体有害,世界环保联盟即将全面禁止这种消毒方法。建议采用广谱性具有强氧化性的高效消毒剂二氧化氯(ClO2)。ClO2极易爆炸,生产和使用时尽量用惰性气体稀释,避免光照、震动或加热。
(1)在ClO2中,所有原子是否都满足8电子结构?______________(填“是”或“否”)。
(2)欧洲一些国家用NaClO3氧化浓盐酸来制取ClO2,同时有Cl2生成,且Cl2的体积为ClO2的一半。这一反应的化学方程式是___________________________________。
(3)浓盐酸在上述反应中显示出来的性质是_______________(填写编号)。
A.只有还原性 B.还原性和酸性
C.只有氧化性 D.氧化性和酸性
(4)若上述反应产生0.1molCl2,转移电子的物质的量为_______________mol。
(5)ClO2为高效低毒的消毒剂,其消毒的效率(以单位质量得到电子数表示)是Cl2的_____________倍。
(6)我国广泛采用将经干燥空气稀释的氯气通入填有固体亚氯酸钠(NaClO2)的柱内制得ClO2,表示这一反应的化学方程式是_______________________________。和欧洲的方法相比,我国这一方法的主要优点是_______________________________。
(1)否 (2)2NaClO3+4HCl=2ClO2+Cl2+2NaCl+2H2O (3)B (4)0.2 (5)2.63
(6) 2NaClO2+Cl2=2NaCl+2ClO2; 对环境的污染较小(生成的ClO2中不含Cl2杂质)
【解析】
试题分析:(1)在ClO2中,氯原子和氧原子的化合价分别是+4价和-2价,所以氧原子满足了8电子的稳定结构,但氯原子没有满足8电子的稳定结构。
(2)根据原子守恒可知,一定还有水和氯化钠生成,所以反应的化学方程式是2NaClO3+4HCl=2ClO2+Cl2+2NaCl+2H2O。
(3)根据方程式可知,盐酸中氯元素的化合价从-1价升高到0价,失去电子,做还原剂。同时还有氯化钠生成,所以盐酸还起酸性的作用,即答案选B。
(4)生成物氯气中的氯原子全部来自于盐酸中的氯原子,所以每生成0.1mol氯气,转移电子的物质的量是0.1mol×2=0.2mol。
(5)71g氯气的物质的量是1mol,在反应中得到2mol电子。而71g二氧化氯的物质的量是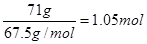 。由于氯元素的化合价是+4价,所以在反应中得到5个电子,所以其消毒的效率(以单位质量得到电子数表示)是Cl2的
。由于氯元素的化合价是+4价,所以在反应中得到5个电子,所以其消毒的效率(以单位质量得到电子数表示)是Cl2的 倍。
倍。
(6)根据原子守恒可知,另外一种生成物应该是氯化钠,所以反应的化学方程式是2NaClO2+Cl2=2NaCl+2ClO2;由于生成的ClO2中不含Cl2杂质,所以和欧洲的方法相比,我国这一方法的主要优点是对环境的污染较小。
考点:考查氯气性质、用途、方程式的书写、环境保护等
点评:本题是高考中的常见题型,试题难度较大,对学生的基础知识、思维能力、答题能力都提出了更高的要求。本题有利于巩固学生的基础知识,有利于培养学生运用知识解决实际问题的能力,有利于拓展学生的思维,开阔学生的思路,提高学生的学习效率。同时也有利于增强学生的环境保护意识,激发学生学习化学的兴趣和学习积极性。

