题目内容
下列热化学方程式中,正确的是( )
2Hg(l)+O2(g) 2HgO(s) ΔH="-181.6" kJ/mol
2HgO(s) ΔH="-181.6" kJ/mol
则Zn(s)+HgO(s) ZnO(s)+Hg(l) ΔH="-259.7" kJ·mol-1
ZnO(s)+Hg(l) ΔH="-259.7" kJ·mol-1
A.甲烷的燃烧热ΔH为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g) CO2(g)+2H2O(g) ΔH="-890.3" kJ·mol-1 CO2(g)+2H2O(g) ΔH="-890.3" kJ·mol-1 |
B.含20.0 g的NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ 的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq) CH3COONa(aq)+H2O(l) ΔH="-57.4" kJ·mol-1 CH3COONa(aq)+H2O(l) ΔH="-57.4" kJ·mol-1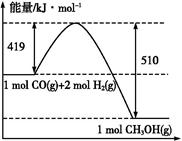 |
C.上图是298 K、101 Pa时CO和H2合成CH3OH(g)的反应过程中能量变化的曲线图,则该反应的热化学方程式为:CO(g)+2H2(g) CH3OH(g) ΔH="+91" kJ·mol-1 CH3OH(g) ΔH="+91" kJ·mol-1 |
D.已知:2Zn(s)+O2(g) 2ZnO(s) ΔH="-701.0" kJ/mol 2ZnO(s) ΔH="-701.0" kJ/mol |
 2HgO(s) ΔH="-181.6" kJ/mol
2HgO(s) ΔH="-181.6" kJ/mol则Zn(s)+HgO(s)
 ZnO(s)+Hg(l) ΔH="-259.7" kJ·mol-1
ZnO(s)+Hg(l) ΔH="-259.7" kJ·mol-1D
燃烧热是在一定条件下,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,水的稳定状态为液态,选项A不正确;醋酸是弱电解质,存在电离平衡,而电离是吸热的,所以选项B不正确;根据图像可知,反应物的总能量高于生成物的总能量,反应是放热反应,ΔH应小于0,选项C不正确;根据盖斯定律可知,选项D正确。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 ;④CHCH;⑤NH3;⑥CH4
;④CHCH;⑤NH3;⑥CH4
 N2(g)+3H2(g),反应时间(t)与容器内气体总压强(p)的数据见下表
N2(g)+3H2(g),反应时间(t)与容器内气体总压强(p)的数据见下表
 O2(g)―→2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1
O2(g)―→2CO2(g)+H2O(l) ΔH=-1 300 kJ·mol-1 O2(g)―→6CO2(g)+3H2O(l) ΔH=-3 295 kJ·mol-1
O2(g)―→6CO2(g)+3H2O(l) ΔH=-3 295 kJ·mol-1