题目内容
【题目】(题文)I. 我们已经学习了同位素、同系物、同素异形体、同分异构体,下面列出了几组物质,请用物质的组号填写下表:
有下列各组物质:
A.O2和O3(臭氧) B.12C和13C C.CH3CH2CH2CH3和CH3CH(CH3)2
D. CH4和C6H14 E.  和
和  F. H+和D+
F. H+和D+
类别 | 同位素 | 同系物 | 同素异形体 | 同分异构体 |
组号 | _______ | _______ | _______ | _______ |
Ⅱ.下图为四种烃的球棍模型,按要求填空

(1)等质量的以上四种烃完全燃烧,消耗O2最多的是_______(填字母序号)
(2)能说明D分子中的碳碳键不是单双键交替的事实是_________(填序号)
①D不能使酸性KMmO4溶液褪色 ②D中碳碳键的键长键能都相等
③邻二元取代产物只有一种 ④间二元取代只有一种
⑤在一定条件下D与H2发生加成反应生成环已烷
Ⅲ.按要求完成下列问题:
(1)丙烯通入到溴的四氯化碳溶液中的化学方程式:_________。
(2)戊烷的某种同分异构体的一氯代物只有一种,其结构简式为_____________。
(3)用系统命名法给下列有机物命名:
① ____________。
____________。
② ________。
________。
【答案】BDACA①②③H3C-CH=CH2 + Br2![]() CH3CHBrCH2Br;C(CH3)42-甲基戊烷4-甲基-2-己烯
CH3CHBrCH2Br;C(CH3)42-甲基戊烷4-甲基-2-己烯
【解析】
I.由“四同”的概念和区别可知12C和13C是碳元素的两种同位素;CH4和C6H14都属于烷烃同系物;O2和O3(臭氧)互为同素异形体;CH3CH2CH2CH3和CH3CH(CH3)2互为同分异构体;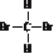 和
和  为同一种物质;H+和D+是由两种不同的氢原子形成的氢离子;故答案依次为:B、D、A、C。Ⅱ.(1)等质量的烃完全燃烧的耗氧量与烃分子中氢元素的质量分数成正比,由此分析可知CH4中氢元素的质量分数最大,故答案为A;(2)若D分子中的碳碳键是单双键交替的,其间位的二元取代物也只有一种、与氢气加后生成物也是环己烷,则④⑤两种说法不能证明D分子中的碳碳键是单双键交替出现的,故答案为①②③;Ⅲ.(1)丙烯通入到溴的四氯化碳溶液中与溴单质发生加成反应,方程式为H3C-CH=CH2 + Br2
为同一种物质;H+和D+是由两种不同的氢原子形成的氢离子;故答案依次为:B、D、A、C。Ⅱ.(1)等质量的烃完全燃烧的耗氧量与烃分子中氢元素的质量分数成正比,由此分析可知CH4中氢元素的质量分数最大,故答案为A;(2)若D分子中的碳碳键是单双键交替的,其间位的二元取代物也只有一种、与氢气加后生成物也是环己烷,则④⑤两种说法不能证明D分子中的碳碳键是单双键交替出现的,故答案为①②③;Ⅲ.(1)丙烯通入到溴的四氯化碳溶液中与溴单质发生加成反应,方程式为H3C-CH=CH2 + Br2![]() CH3CHBrCH2Br;(2)一氯代物只有一种的戊烷的同分异构体为新戊烷,结构简式为C(CH3)4或
CH3CHBrCH2Br;(2)一氯代物只有一种的戊烷的同分异构体为新戊烷,结构简式为C(CH3)4或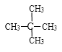 ;(3)①该烷烃的系统名称为2-甲基戊烷;②该烯烃的系统名称为4-甲基-2-己烯。
;(3)①该烷烃的系统名称为2-甲基戊烷;②该烯烃的系统名称为4-甲基-2-己烯。

【题目】现有部分短周期主族元素的性质或原子结构如下表:
元素编号 | 元素性质或原子结构 |
T | M层上电子数是K层上电子数3倍 |
X | 最外层电子数是次外层电子数的2倍 |
Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
Z | 元素最高正价是+7价 |
(1)元素X的一种同位素可测定文物年代,这种同位素的符号是____。
(2)元素Y与氢元素形成一种离子YH4+,写出该微粒的电子式____(用元素符号表示)。
(3)元素Z与元素T相比,非金属性较强的是____(用元素符号表示),下列表述中能证明这一事实的是____。
a.常温下Z的单质和T的单质状态不同
b.Z的氢化物比T的氢化物稳定
c.一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)T的一种氧化物能使Z单质的水溶液褪色反应的离子方程式为______。
(5)T在周期表中的位置是第________周期,第_________族。